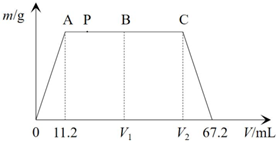
一定条件下,向10mLCa(OH)2和NaOH的混合溶液中缓慢通入足量的CO2气体,生成沉淀的质量(m)与通入CO2气体的体积(V)(已折算成标准状况)的关系如图所示。
回答下列问题:
(1)①A点前发生反应的离子方程式是 CO2+Ca2++2OH-=CaCO3↓+H2OCO2+Ca2++2OH-=CaCO3↓+H2O;②B→C发生反应的离子方程式是 CO2-3+H2O+CO2=2HCO-3CO2-3+H2O+CO2=2HCO-3。
(2)A点对应生成沉淀的质量为 0.05g0.05g;C点对应的CO2的体积是 56ml56ml。
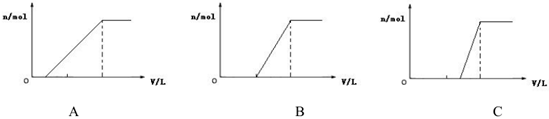
(3)向A点和B点间的P点所对应的溶液中逐滴滴加盐酸,滴加盐酸的体积与产生气体的物质的量之间所对应的图象可能是 CC(填字母)。
(4)混合稀溶液中Ca(OH)2和NaOH的物质的量浓度之比为 1:41:4。
(5)若取2L该混合溶液,通入一定体积的CO2,结果生成了5g沉淀,则通入CO2气体的体积(标准状况)可能是 12.32L12.32L。
CO
2
-
3
HCO
-
3
CO
2
-
3
HCO
-
3
【答案】CO2+Ca2++2OH-=CaCO3↓+H2O;+H2O+CO2=2;0.05g;56ml;C;1:4;12.32L
CO
2
-
3
HCO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/1 4:0:8组卷:11引用:1难度:0.5
相似题
-
1.用1L 1.0mol/LNaOH溶液吸收0.8molCO2,所得溶液中的
和CO2-3的物质的量浓度之比约是( )HCO-3发布:2024/12/3 7:30:1组卷:84引用:6难度:0.7 -
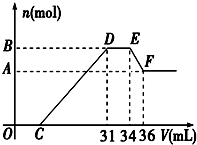 2.已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.则:
2.已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.则:
(1)试写出DE段、EF段所发生反应的离子方程式:
DE段EF段
(2)合金中铝的物质的量为mol
(3)合金中金属的物质的量共为mol
(4)求出C点的值为ml.发布:2024/11/18 8:0:1组卷:18引用:1难度:0.3 -
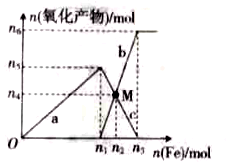 3.在1L 2mol•L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示。回答下列问题:
3.在1L 2mol•L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示。回答下列问题:
(1)与曲线a对应的离子方程式为。
(2)曲线b代表的微粒为;n2的值为。
(3)若M点时再加入VL2mol•L-1的稀硝酸,恰好反应完全,则V为。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为。发布:2024/11/18 8:0:1组卷:9引用:1难度:0.5


