不依赖植物,人工合成碳水化合物,一直是世界各国科学家的梦想。我国中科院天津工业生物技术研究所的科学家在国际上首次突破二氧化碳人工合成淀粉,研究碳的化合物对减少CO2在大气中累积及实现可再生能源的有效利用具有重要意义。CO2和H2在一定条件下能发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH。回答下列问题:
(1)该反应中反应物与生成物的能量与活化能的关系如图所示,该反应的ΔH=Ea1-Ea2Ea1-Ea2kJ•mol-1(用含Ea1和Ea2的代数式表示)。
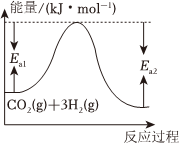
(2)恒温恒容条件下,下列不能说明该反应达到平衡状态的是 BCBC(填标号)。
A.v(CO2)正=v(CH3OH)逆
B.CH3OH(g)的体积分数与H2O(g)的体积分数相等
C.混合气体的密度不再变化
D.混合气体的压强不再变化
(3)一定温度下,向一体积为3L的刚性密闭容器中充入3molCO2和6molH2,此时容器内的压强为45kPa,发生上述反应,进行5min时达到平衡,此时容器内的压强为30kPa,则0~5min内用H2表示的化学反应速率为 0.50.5mol•L-1•min-1。该温度下,该反应的平衡常数K=250081250081L2•mol-2。
(4)以CO2、H2为原料合成CH3OH时,还发生了副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH1=+41.5kJ•mol-1。一定压强下,按照一定比例投入原料,CO2的平衡转化率在300℃以下随温度升高而减小,在300℃以上随温度升高而增大,甲醇的产量在300℃以下随温度升高而减小,在300℃以上随温度升高基本不变,理由是 升高温度主反应逆向进行,副反应正向进行,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度升高温度主反应逆向进行,副反应正向进行,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度。
2500
81
2500
81
【答案】Ea1-Ea2;BC;0.5;;升高温度主反应逆向进行,副反应正向进行,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度
2500
81
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/17 8:0:8组卷:21引用:1难度:0.5
相似题
-
1.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
2.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。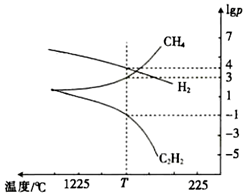
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


