某温度下,将2mol E和3mol F充入一密闭容器中,发生反应:aE(g)+F(g)⇌M(g)+N(g),平衡常数K等于1,在温度不变的情况下将容器的体积扩大为原来的2倍,F百分含量不发生变化,则E的转化率为( )
【考点】用化学平衡常数进行计算.
【答案】A
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/27 14:0:0组卷:451引用:3难度:0.7
相似题
-
1.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。H2S与CO2在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。在温度为610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=,反应平衡常数K=;
(2)在620K下重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2NH4+,该反应的ΔH0(填“>”、“<”或“=”);
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是(填标号)。
a.H2S
b.CO2
c.COS
d.N2发布:2024/6/27 10:35:59组卷:270引用:1难度:0.7 -
2.某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得资料如下:
①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te
③氧气、硫、硒、碲与1mol H2反应热如下表所示。
请回答下列问题:物质 O2 S Se Te △H(kJ•mol-1) -242 -20 81
(1)写出氧族元素中两种含18个电子的氢化物的化学式、;
(2)写出硒化氢分解的热化学方程式:;
(3)①一定温度下,在容积为1L的某容器中,充入2molSO2、1molO2.最终达到平衡后,容器内压强变为原来的,该温度下该反应的平衡常数为56
②在其他条件不变的情况下,将平衡后容器的体积压缩到原来的,下列有关该体系的说法正确的是12
a.SO2的浓度减小
b.正反应速率加快,逆反应速率也加快
c.SO3的物质的量增加
d.重新平衡时增大。n(O2)n(SO3)发布:2024/6/27 10:35:59组卷:38引用:2难度:0.5 -
3.(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)⇌ETBE(g)△H。回答下列问题:
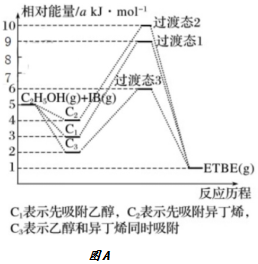
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图A所示,该反应的△H=kJ•mol-1。反应历程的最优途径是。(填C1、C2或C3)
(2)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为2CO(g)+SO2(g)2CO2(g)+S(l)△H=-270kJ•mol-1。催化剂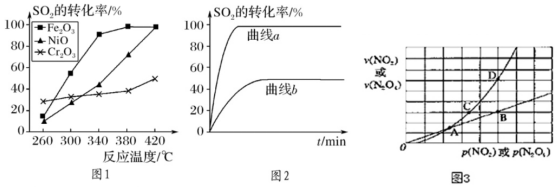
①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是:。
②某科研小组用Fe2O3作催化剂。在380℃时,分别研究了n(CO):n(SO2)为1:1、3:1时SO2转化率的变化情况(图2)。则图2中表示n(CO):n(SO2)=3:1的变化曲线为。
(3)已知NO2存在如下平衡:2NO2(g)⇌N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图3所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=;在图标出点中,指出能表示反应达到平衡状态的点是,理由是。发布:2024/6/27 10:35:59组卷:86引用:1难度:0.5


