磁铁氧体是用量很大的一种磁性材料,也是电子信息和家电工业等的重要基础功能性材料,Mn3O4是生产软磁铁氧体材料的主要原料,实验室以SO2气体制备少量纯净的Mn3O4。
【资料】亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
【步骤Ⅰ】制备MnSO4溶液
在三颈烧瓶中(装置见图1)加入一定量MnO2和水搅拌,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时,停止通SO2,继续反应片刻后过滤得MnSO4溶液。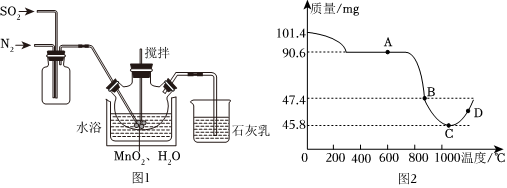
(1)烧杯中石灰乳的作用为 吸收没有反应的二氧化硫,防止二氧化硫污染空气吸收没有反应的二氧化硫,防止二氧化硫污染空气。
(2)三颈烧瓶中生成MnSO4的反应化学方程式为 MnO2+SO2=MnSO4MnO2+SO2=MnSO4。
(3)步骤Ⅰ中,先通入氮气的目的是 排尽装置内空气,防止二氧化硫通入水形成亚硫酸被空气中的氧气氧化排尽装置内空气,防止二氧化硫通入水形成亚硫酸被空气中的氧气氧化,为使SO2尽可能转化完全,在不改变固液投料比,且通入的SO2和N2比例一定的条件下,可采取的合理措施有:水浴加热、搅拌搅拌(任写一条)。
【步骤Ⅱ】制备MnSO4•H2O晶体
(4)利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,用压力釜加压、升温结晶升温结晶、过滤、洗涤、低温干燥,得纯净的MnSO4•H2O晶体。
【步骤Ⅲ】制备Mn3O4
准确称取101.4mgMnSO4•H2O,将MnSO4•H2O晶体在空气中高温煅烧,图2是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
(5)试通过计算确定反应至图2中C点时所对应的剩余固体成分的化学式 Mn3O4Mn3O4。
(6)制备Mn3O4固体时温度不宜超过 1000℃1000℃,原因 4Mn3O4+O2高温 6Mn2O34Mn3O4+O2高温 6Mn2O3(用化学方程式表示)。
4
M
n
3
O
4
+
O
2
高温
6
M
n
2
O
3
4
M
n
3
O
4
+
O
2
高温
6
M
n
2
O
3
【考点】物质的相互转化和制备.
【答案】吸收没有反应的二氧化硫,防止二氧化硫污染空气;MnO2+SO2=MnSO4;排尽装置内空气,防止二氧化硫通入水形成亚硫酸被空气中的氧气氧化;搅拌;升温结晶;Mn3O4;1000℃;
4
M
n
3
O
4
+
O
2
高温
6
M
n
2
O
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/21 8:0:9组卷:87引用:2难度:0.4
相似题
-
1.新冠肺炎疫情防控期间,西安市各学校开展全域喷洒低浓度、有效成分是次氯酸钠的“84”消毒液进行消毒。如图所示是模拟制备“84”消毒液的流程(Cl2是一种黄绿色的有毒气体)。请回答下列问题:
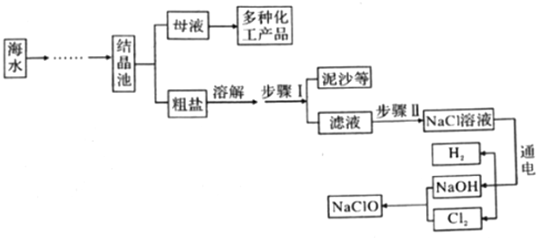
(1)NaOH的俗称为(写一种)。
(2)步骤Ⅱ中,通常用碳酸钠溶液除去滤液中的氯化钙杂质,请写出有关反应的化学方程式。
(3)电解水时,一般在水中加入少量NaOH以增强水的导电性,不能加入NaCl的原因是。发布:2025/1/3 8:0:1组卷:6引用:1难度:0.5 -
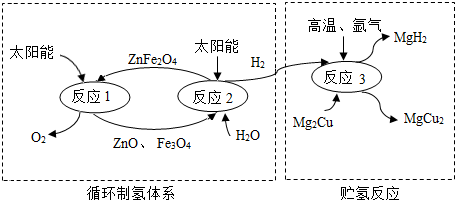 2.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5
2.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5 -
3.某种家用的消毒液的主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,下列说法错误的是( )
发布:2025/1/3 8:0:1组卷:71引用:1难度:0.7


