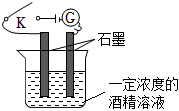
某兴趣小组同学用图1所示装置,向一定体积的0.01mol/LBa(OH)2溶液中逐滴滴加0.2mol/LH2SO4溶液,不断搅拌并测定溶液导电能力的变化,实验测得混合溶液的导电能力随时间变化的曲线如图2所示。

(1)用化学用语解释未滴加硫酸时,接通电源后灯泡变亮的原因:Ba(OH)2=Ba2++2OH-Ba(OH)2=Ba2++2OH-;
(2)实验过程中观察到的现象是:烧杯中 生成白色沉淀生成白色沉淀,小灯泡 由亮→灭(或暗)→亮由亮→灭(或暗)→亮。
(3)写出Ba(OH)2溶液与稀H2SO4反应的离子方程式 Ba2++2OH-+2H++SO2-4=BaSO4↓+2H2OBa2++2OH-+2H++SO2-4=BaSO4↓+2H2O。
(4)B点代表反应恰好完全,用Na2SO4溶液替代H2SO4溶液,重复上述实验进行对照,分析二者现象上的不同之处为 恰好完全反应时,小灯泡变暗但比H2SO4的亮;且换为Na2SO4溶液后的B点导电能力更大恰好完全反应时,小灯泡变暗但比H2SO4的亮;且换为Na2SO4溶液后的B点导电能力更大。
SO
2
-
4
SO
2
-
4
【考点】物质导电性分析.
【答案】Ba(OH)2=Ba2++2OH-;生成白色沉淀;由亮→灭(或暗)→亮;Ba2++2OH-+2H++=BaSO4↓+2H2O;恰好完全反应时,小灯泡变暗但比H2SO4的亮;且换为Na2SO4溶液后的B点导电能力更大
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/29 2:0:2组卷:7引用:1难度:0.6