当前位置:
试题详情
长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度。
| 实验方案 | 步骤1 | 步骤2 |
| 取待检测液于试管中,向其中滴加KSCN溶液 | 取待检测液于试管中,向其中滴加少量酸性高锰酸钾溶液 | |
| 实验现象 |
溶液变红 溶液变红
|
紫色褪去 紫色褪去
|
| 实验结论 | FeSO4溶液部分变质 | |
②若要使部分变质的FeSO4复原,方法是
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
(用离子方程式表示)。(2)利用部分变质的FeSO4溶液制备Fe2O3。
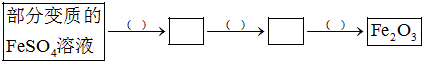
①“( )”中所填是所需试剂或条件,分别为
H2O2溶液
H2O2溶液
、NaOH溶液
NaOH溶液
、加热
加热
、“ ”中所填是含铁物质的化学式,分别是
”中所填是含铁物质的化学式,分别是 Fe3+
Fe3+
、Fe(OH)3
Fe(OH)3
(以离子形式存在的可写离子符号)。②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为
0.2mol/L
0.2mol/L
。(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
不能,维生素C也具有还原性,若其过量,也可使酸性高锰酸钾溶液褪色,则无法说明一定有Fe2+生成
不能,维生素C也具有还原性,若其过量,也可使酸性高锰酸钾溶液褪色,则无法说明一定有Fe2+生成
。【考点】铁离子与亚铁离子的检验;铁盐和亚铁盐的相互转化.
【答案】溶液变红;紫色褪去;2Fe3++Fe=3Fe2+;H2O2溶液;NaOH溶液;加热;Fe3+;Fe(OH)3;0.2mol/L;不能,维生素C也具有还原性,若其过量,也可使酸性高锰酸钾溶液褪色,则无法说明一定有Fe2+生成
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/31 8:0:9组卷:10引用:3难度:0.7
相似题
-
1.将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即可显血红色的是( )
发布:2024/11/19 8:0:22组卷:190引用:10难度:0.7 -
2.为探究铁和稀硝酸反应后溶液中铁元素存在形式,某化学实验兴趣小组设计实验如下:
提出假设:
假设1:溶液中只有Fe2+;
假设2:;
假设3:.
设计实验方案、验证假设:(请完成下列表格)
问题分析:实验操作 预期现象与结论 1. 若溶液不变红,则假设1正确;
若溶液变红,则假设2或假设3正确2.另取少许反应后溶液于试管中,滴加1-2滴0.01mol/L KMnO4溶液,振荡
(1)若已知铁和稀硝酸反应生成标准状况下NO气体2.24L,则上述反应中参加反应的硝酸物质的量为;
(2)若假设1正确,请写出铁和稀硝酸发生该反应的离子方程式:;
(3)某同学向反应后溶液中滴加适量NaOH溶液,未发现白色沉淀产生,由此断定溶液中没有Fe2+,他这种说法对吗?请分析理由:.发布:2024/11/4 8:0:2组卷:34引用:1难度:0.5 -
 3.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的实验,实验设计错误的是( )发布:2024/12/16 6:0:1组卷:55引用:2难度:0.7
3.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的实验,实验设计错误的是( )发布:2024/12/16 6:0:1组卷:55引用:2难度:0.7


