FeCl3为棕褐色固体,在化工生产中有许多应用。
(1)26Fe元素有54Fe、546Fe、57Fe、58Fe四种核素,它们互为 同位素同位素,54Fe的中子数为 2828,1个56Fe原子的质量是 56NAg56NAg。
(2)书写利用单质反应制备氯化铁的化学方程式,并标出电子转移的方向和数目: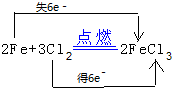
 。
。
(3)氯化铁溶于水后,电离方程式为 FeCl3=Fe3++3Cl-FeCl3=Fe3++3Cl-。检验氯化铁溶液中的溶质负离子的操作、现象和结论是:取样,加硝酸银和稀硝酸,若产生白色沉淀,则含有氯离子取样,加硝酸银和稀硝酸,若产生白色沉淀,则含有氯离子。
(4)将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系甲、乙、丙。用红色水平分别照射分散系甲和丙,现象的差异为:丙中产生光亮的光线轨迹,甲中没有丙中产生光亮的光线轨迹,甲中没有。向丙中加入少量稀盐酸,会出现和乙中相同的现象,原因是:氢氧化铁胶体遇到稀盐酸中的异种电荷离子,发生了聚沉氢氧化铁胶体遇到稀盐酸中的异种电荷离子,发生了聚沉。

(5)5.410g氯化铁晶体(FeCl3⋅6H2O)与100mLAgNO3溶液恰好完全沉淀,则AgNO3溶液的物质的量浓度为 0.6mol⋅L-10.6mol⋅L-1。
(6)若用氯化铁晶体(FeCl3⋅6H2O)配制100mL1.000mol⋅L-1FeCl3溶液,下列会造成所配溶液物质的量浓度偏高的是 ACAC。(双选)
A.定容时,俯视凹液面最低点
B.转移时,有少量液体溅出
C.FeCl3晶体已部分失水
D.烧杯、玻璃棒未洗涤
(7)将饱和氯化铁溶液与小苏打溶液混合时,会产生红褐色沉淀和一种无色无味且能使石灰水变浑浊的气体,则该气体在标况下的密度为 1.964g⋅L-11.964g⋅L-1。(保留三位小数)
56
N
A
56
N
A


【考点】铁及其化合物的相互转化;核素;氢氧化铁胶体的制备;质量数与质子数、中子数之间的相互关系;氧化还原反应的电子转移数目计算;铁离子与亚铁离子的检验;胶体的重要性质;物质的量浓度的相关计算;配制一定物质的量浓度的溶液;铁盐和亚铁盐的相互转化.
【答案】同位素;28;g; ;FeCl3=Fe3++3Cl-;取样,加硝酸银和稀硝酸,若产生白色沉淀,则含有氯离子;丙中产生光亮的光线轨迹,甲中没有;氢氧化铁胶体遇到稀盐酸中的异种电荷离子,发生了聚沉;0.6mol⋅L-1;AC;1.964g⋅L-1
;FeCl3=Fe3++3Cl-;取样,加硝酸银和稀硝酸,若产生白色沉淀,则含有氯离子;丙中产生光亮的光线轨迹,甲中没有;氢氧化铁胶体遇到稀盐酸中的异种电荷离子,发生了聚沉;0.6mol⋅L-1;AC;1.964g⋅L-1
56
N
A
 ;FeCl3=Fe3++3Cl-;取样,加硝酸银和稀硝酸,若产生白色沉淀,则含有氯离子;丙中产生光亮的光线轨迹,甲中没有;氢氧化铁胶体遇到稀盐酸中的异种电荷离子,发生了聚沉;0.6mol⋅L-1;AC;1.964g⋅L-1
;FeCl3=Fe3++3Cl-;取样,加硝酸银和稀硝酸,若产生白色沉淀,则含有氯离子;丙中产生光亮的光线轨迹,甲中没有;氢氧化铁胶体遇到稀盐酸中的异种电荷离子,发生了聚沉;0.6mol⋅L-1;AC;1.964g⋅L-1【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/7 9:0:2组卷:38引用:1难度:0.7