络氨铜是一种常用的农药中间体。为充分利用资源,变废为宝,在实验室中探究采用机床切削含铁的粗铜屑制备产品[Cu(NH3)4]SO4•H2O(能溶于水,难溶于乙醇),具体流程如图。

回答下列问题:
(1)步骤①中与产品有关的反应离子方程式是 Cu+2H++H2O2=Cu2++2H2OCu+2H++H2O2=Cu2++2H2O。
(2)步骤②中调节pH至3.0左右,主要目的是 使三价铁离子完全转化成Fe(OH)3沉淀使三价铁离子完全转化成Fe(OH)3沉淀。检验悬浊液中杂质离子沉淀完全的方法是 取反应后少量悬浊液于试管中,滴入几滴KSCN溶液,若无明显现象,则沉淀完全取反应后少量悬浊液于试管中,滴入几滴KSCN溶液,若无明显现象,则沉淀完全。
(3)步骤③中加入95%的乙醇的作用是 有利于产品的析出有利于产品的析出。
(4)步骤⑤正确的干燥方法是 BB。(填标号)
A.在烘箱中烘干
B.自然风干或晾干
C.在盛有浓硫酸的干燥器中干燥
(5)书写反应③中得到蓝色晶体的离子方程式 Cu2++4NH3•H2O+SO2-4=[Cu(NH3)4]SO4•H2O↓+3H2OCu2++4NH3•H2O+SO2-4=[Cu(NH3)4]SO4•H2O↓+3H2O。
SO
2
-
4
SO
2
-
4
【考点】制备实验方案的设计.
【答案】Cu+2H++H2O2=Cu2++2H2O;使三价铁离子完全转化成Fe(OH)3沉淀;取反应后少量悬浊液于试管中,滴入几滴KSCN溶液,若无明显现象,则沉淀完全;有利于产品的析出;B;Cu2++4NH3•H2O+=[Cu(NH3)4]SO4•H2O↓+3H2O
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/8 8:0:9组卷:27引用:2难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
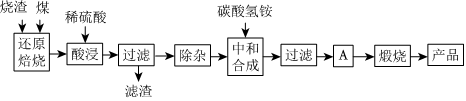
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
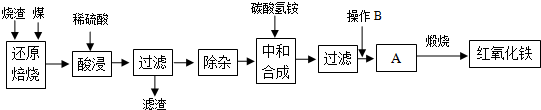
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
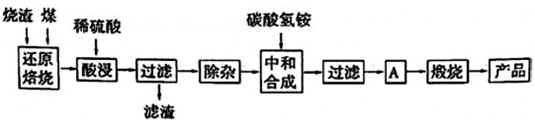
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


