纳米材料一直是人们研究的重要课题,例如纳来级Fe粉表面积大,具有超强的磁性,高效的催化性等优良性质。
Ⅰ.实验室采用气相还原法制备纳米级Fe,其流程如图所示:
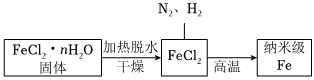
(1)生成纳米级Fe粉的化学方程式为 FeCl2+H2 高温 Fe+2HClFeCl2+H2 高温 Fe+2HCl。
Ⅱ.查阅资料得知:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用图甲所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
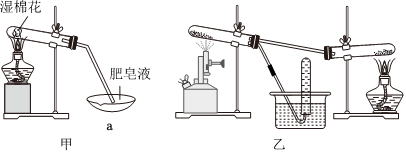
(2)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 Fe+H2O(g) 高温 FeO+H2Fe+H2O(g) 高温 FeO+H2。
(3)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
高温
高温
高温
高温
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到的黑色粉末X(假定为均匀的)。取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
如铁粉过量,则不能生成Fe3+
如铁粉过量,则不能生成Fe3+
(用简要文字描述)。(4)丁同学称取5.60gFe粉,用乙装置反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为
67.4%
67.4%
(结果保留三位有效数字)。某同学为了验证Fe2+是否能将H2SO3氧化成
S
O
2
-
4
(5)检验吸收液中是否含有
S
O
2
-
4
取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀
取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀
。(6)请写出FeCl3吸收SO2的离子方程式:
2Fe3++SO2+2H2O═2Fe2++4H++
SO
2
-
4
2Fe3++SO2+2H2O═2Fe2++4H++
,反应中的氧化产物是 SO
2
-
4
SO
2
-
4
SO
2
-
4
(7)吸收液中除了含有H+、Cl-、
S
O
2
-
4
①提出假设。
假设1:溶液中存在Fe2+
假设2:溶液中存在Fe3+、Fe2+
假设3:溶液中存在
Fe2+、H2SO3
Fe2+、H2SO3
。②设计方案,进行实验,验证假设。
请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1mol/LKMnO4溶液、0.1mol/LKSCN溶液、品红溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,滴入 1~2滴0.1 mol•L-1KSCN溶液 1~2滴0.1 mol•L-1KSCN溶液 |
若 未出现血红色 未出现血红色 ,则假设2成立,1、3不成立 |
| 步骤2: 另取2~3 mL样品溶液于试管中,滴入1~2 mL品红稀溶液 另取2~3 mL样品溶液于试管中,滴入1~2 mL品红稀溶液 |
若 品红溶液红色褪去 品红溶液红色褪去 ,则假设3成立 |
| 步骤3(可补充): 另取2~3 mL样品溶液于试管中,滴入1~2 mL品红稀溶液 另取2~3 mL样品溶液于试管中,滴入1~2 mL品红稀溶液 |
若品红溶液不褪色,则假设3不成立,假设1成立 若品红溶液不褪色,则假设3不成立,假设1成立
|
【考点】制备实验方案的设计.
【答案】FeCl2+H2 Fe+2HCl;Fe+H2O(g) FeO+H2;如铁粉过量,则不能生成Fe3+;67.4%;取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀;2Fe3++SO2+2H2O═2Fe2++4H++;;Fe2+、H2SO3;1~2滴0.1 mol•L-1KSCN溶液;未出现血红色;另取2~3 mL样品溶液于试管中,滴入1~2 mL品红稀溶液;品红溶液红色褪去;另取2~3 mL样品溶液于试管中,滴入1~2 mL品红稀溶液;若品红溶液不褪色,则假设3不成立,假设1成立
高温
高温
SO
2
-
4
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/11 8:0:9组卷:33引用:1难度:0.4
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
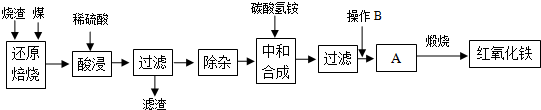
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
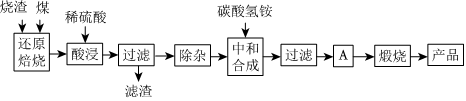
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
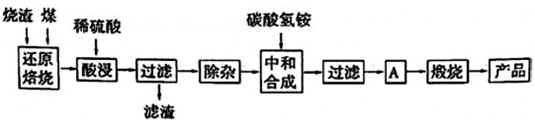
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


