回答下列问题:
(1)若金属钠等活泼金属着火时,应该用干沙土干沙土来灭火。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是cc。
a.有气体生成 b.钠熔化成小球并在液面上游动
c.烧杯底部有银白色的金属钙生成 d.溶液变浑浊
(2)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3性质的说法中,正确的是dd。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d. NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2除杂
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁不溶于水,但易溶于稀酸,广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式:2MgO2+4H+=2Mg2++2H2O+O2↑2MgO2+4H+=2Mg2++2H2O+O2↑。
(4)某无色稀溶液X中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH4+中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。

则X中一定含有的阳离子是Al3+、Mg2+、NH4+Al3+、Mg2+、NH4+,bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2OAl(OH)3+OH-=AlO2-+2H2O。
(5)在1L某酸性溶液中离子浓度的分析结果如下表
| 离子 | Mg2+ | Al3+ | SO42- | Cl- |
| c/(mol/L) | 0.5×10-2 | 1.0×10-2 | 0.5×10-2 | 3.0×10-2 |
100
100
mL。【答案】干沙土;c;d;2MgO2+4H+=2Mg2++2H2O+O2↑;Al3+、Mg2+、NH4+;Al(OH)3+OH-=AlO2-+2H2O;100
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/20 8:0:8组卷:31引用:2难度:0.5
相似题
-
1.用1L 1.0mol/LNaOH溶液吸收0.8molCO2,所得溶液中的
和CO2-3的物质的量浓度之比约是( )HCO-3发布:2024/12/3 7:30:1组卷:84引用:6难度:0.7 -
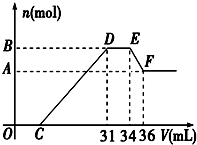 2.已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.则:
2.已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.则:
(1)试写出DE段、EF段所发生反应的离子方程式:
DE段EF段
(2)合金中铝的物质的量为mol
(3)合金中金属的物质的量共为mol
(4)求出C点的值为ml.发布:2024/11/18 8:0:1组卷:18引用:1难度:0.3 -
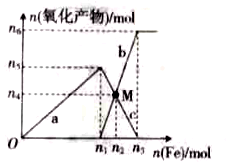 3.在1L 2mol•L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示。回答下列问题:
3.在1L 2mol•L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示。回答下列问题:
(1)与曲线a对应的离子方程式为。
(2)曲线b代表的微粒为;n2的值为。
(3)若M点时再加入VL2mol•L-1的稀硝酸,恰好反应完全,则V为。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为。发布:2024/11/18 8:0:1组卷:9引用:1难度:0.5


