电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。小明同学将适量Ba(OH)2溶液置于烧杯中并插入电导率传感器(如图1),往其中持续滴加稀硫酸,测得溶液的电导率变化如图2所示。请判断甲、乙两条曲线变化中哪条符合上述实验过程并作出合理解释。

【考点】中和反应及其应用.
【答案】甲、乙两条曲线变化中甲曲线符合上述实验过程,理由是:氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,硫酸钡固体和纯水都不导电;在氢氧化钡没有反应完之前,溶液中的离子浓度不断减小,电导率不断减小;当恰好完全反应时,溶液中不存在能够自由移动的离子,此时导电率为零;恰好完全反应后,继续滴加稀硫酸,溶液中的离子浓度增大,电导率又开始增大。
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/6 1:0:8组卷:30引用:3难度:0.5
相似题
-
1.电导率是衡量溶液导电能力大小的物理量,在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比,盐酸和氢氧化钠反应电导率曲线如图所示,以下分析不正确的是( )
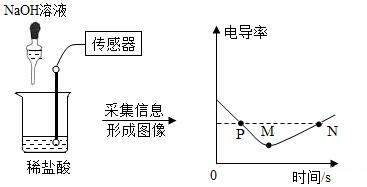 发布:2024/12/28 15:30:1组卷:79引用:6难度:0.5
发布:2024/12/28 15:30:1组卷:79引用:6难度:0.5 -
2.向盛有50g 10% Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,如图(纵坐标表示烧杯中其他量的变化)所有有关量的变化与所加入稀硫酸质量的关系错误的是( )
发布:2024/12/28 15:30:1组卷:16引用:4难度:0.5 -
3.等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液pH=7,则( )
发布:2024/12/28 15:0:1组卷:136引用:10难度:0.5


