实验室里迅速制备少量氯气可利用如下反应:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑,此反应在常温下就可以迅速进行,而且对盐酸浓度要求不高.
(1)标出上述氧化还原反应中电子转移的方向和数目: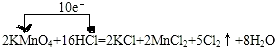
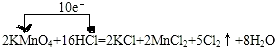 .
.
(2)该反应中,氧化剂是KMnO4KMnO4,还原剂是HClHCl.
(3)HCl在此反应过程中表现出的化学性质有ABAB.
A.酸性 B.还原性C.氧化性 D.挥发性
(4)结合此反应原理,联系实际思考,实验室处理含MnO-4的废液时,要特别注意什么问题?(氯气有毒)
MnO-4具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2MnO-4具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2.
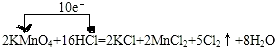
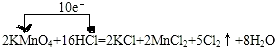
M
n
O
-
4
M
n
O
-
4
M
n
O
-
4
【考点】氧化还原反应的基本概念及规律.
【答案】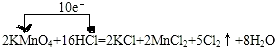 ;KMnO4;HCl;AB;具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2
;KMnO4;HCl;AB;具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2
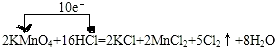 ;KMnO4;HCl;AB;
;KMnO4;HCl;AB;M
n
O
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/17 8:0:9组卷:18引用:4难度:0.3
相似题
-
1.根据下列两个反应判断:2Cu+O2=2CuO,2Cu+S=Cu2S,下列叙述中错误的是( )
发布:2024/12/30 14:30:1组卷:16引用:2难度:0.9 -
2.实验证明,在一定温度和压强下,用铜的化合物做催化剂,甲烷(CH4)与氧气反应只生成甲醇(CH3OH)。下列叙述正确的是( )
发布:2025/1/7 8:0:2组卷:2引用:1难度:0.7 -
3.将适量的SO2通入Fe(NO3)3溶液中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是( )
发布:2024/12/30 14:30:1组卷:27引用:2难度:0.6


