研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。
(1)减少碳排放的方法有很多,CO2转化成有机化合物可有效实现碳循环,如下反应:
a.6CO2+6H2O光合作用C6H12O6+6O2
b.CO2+3H2催化剂加热CH3OH+H2O
c.2CO2+6H2催化剂加热CH2=CH2+4H2O
上述反应中原子利用率最高的是 bb(填编号)。
(2)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)ΔH1=-156.9kJ•mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ•mol-1
已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-395.6kJ•mol-1,
则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-634.3kJ⋅mol-1-634.3kJ⋅mol-1。
(3)利用电化学方法通过微生物电催化将CO2有效地转化为H2C2O4,装置如图1所示。阴极区电极反应式为 2CO2+2e-+2H+=H2C2O42CO2+2e-+2H+=H2C2O4;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是 温度过高微生物催化能力降低或催化剂失活温度过高微生物催化能力降低或催化剂失活。
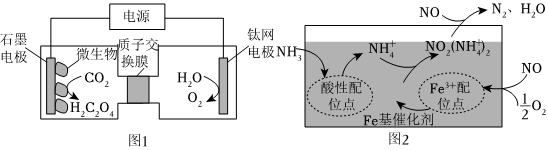
(4)研究脱除烟气中的NO是环境保护、促进社会可持续发展的重要课题。有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图2所示,该过程可描述为 在Fe基催化剂表面,NH3吸附在酸性配位点上形成NH+4,NO与O2吸附在Fe3+配位点上形成NO2,然后NH+4与NO2结合生成NO2(NH+4)2,最后NO2(NH+4)2与NO反应生成N2、H2O,并从催化剂表面逸出在Fe基催化剂表面,NH3吸附在酸性配位点上形成NH+4,NO与O2吸附在Fe3+配位点上形成NO2,然后NH+4与NO2结合生成NO2(NH+4)2,最后NO2(NH+4)2与NO反应生成N2、H2O,并从催化剂表面逸出。
(5)近年来,低温等离子技术是在高压放电下,O2产生O*自由基,O*自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。
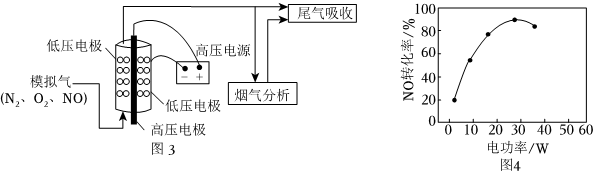
①等离子体技术在低温条件下可提高NO的转化率,原因是 NO与O2反应生成NO2是放热反应,低温时有利于反应的正向进行NO与O2反应生成NO2是放热反应,低温时有利于反应的正向进行。
②其他条件相同,等离子体的电功率与NO的转化率关系如图4所示,当电功率大于30W时,NO转化率下降的原因可能是 功率增大时,会产生更多的O*自由基,NO更易被氧化为NO2,功率增大,N2和O2在放电时会生成NO;相比而言,后者产生的NO更多功率增大时,会产生更多的O*自由基,NO更易被氧化为NO2,功率增大,N2和O2在放电时会生成NO;相比而言,后者产生的NO更多。
光合作用
催化剂
加热
催化剂
加热
2
C
O
2
+
2
e
-
+
2
H
+
=
H
2
C
2
O
4
2
C
O
2
+
2
e
-
+
2
H
+
=
H
2
C
2
O
4
N
H
+
4
N
H
+
4
N
O
2
(
N
H
+
4
)
2
N
O
2
(
N
H
+
4
)
2
N
H
+
4
N
H
+
4
N
O
2
(
N
H
+
4
)
2
N
O
2
(
N
H
+
4
)
2
【考点】用盖斯定律进行有关反应热的计算;化学平衡的影响因素.
【答案】b;-634.3kJ⋅mol-1;;温度过高微生物催化能力降低或催化剂失活;在Fe基催化剂表面,NH3吸附在酸性配位点上形成,NO与O2吸附在Fe3+配位点上形成NO2,然后与NO2结合生成,最后与NO反应生成N2、H2O,并从催化剂表面逸出;NO与O2反应生成NO2是放热反应,低温时有利于反应的正向进行;功率增大时,会产生更多的O*自由基,NO更易被氧化为NO2,功率增大,N2和O2在放电时会生成NO;相比而言,后者产生的NO更多
2
C
O
2
+
2
e
-
+
2
H
+
=
H
2
C
2
O
4
N
H
+
4
N
H
+
4
N
O
2
(
N
H
+
4
)
2
N
O
2
(
N
H
+
4
)
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/27 4:0:8组卷:52引用:2难度:0.7
相似题
-
 1.第五主族的磷单质及其化合物在工业上有广泛应用.
1.第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H已知相同条件下:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H12Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2SiO2(s)+CaO(s)=CaSiO3(s)△H3用△H1、△H2和△H3表示△H,则△H=;
(2)白磷与氧气反应生成P4O10固体.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图1的分子结构和有关数据通过计算写出该反应的热化学方程式为.
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如图2)之间脱去两个水分子产物,其结构式为,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为.
(4)次磷酸(H3PO2)为一元酸,分子中含一个羟基,其钠盐的正盐的化学式为,该盐可用于工业上的化学镀镍.①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)□Ni2++□H2PO2-+□=□Ni++□H2PO3-+□
(b)6H2PO-2+2H+=2P+4H2PO3-+3H2↑请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.原理上的不同点:;化学镀的优点:.发布:2024/11/19 8:0:1组卷:77引用:2难度:0.1 -
2.氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.联氨(又称肼,N2H4或H2N-NH2,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为,其中氮的化合价为;
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,该反应中还原剂与氧化剂的物质的量之比为2:1,反应的化学方程式为.
(3)①2O2(g)+N2(g)═N2O4(g)△H1
②ON2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1038.6kJ•mol-1
上述反应热效应之间的关系式为△H4=,联氨和N2O4可作为火箭推进剂的主要原因为.
(4)联氨可用作火箭燃料,燃烧时发生的反应是N2O4(l)+2N2O4(l)═3N2(g)+4H2O(g)△H=-1038.6kJ•mol-1,若该反应中有4molN-H键断裂,则反应放出的热量为kJ.发布:2024/11/18 8:0:1组卷:12引用:0难度:0.9 -
3.已知在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+O2(g)═SO2(g)+H2O(g) ΔH132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g) ΔH232
③H2S(g)+O2(g)═S(g)+H2O(g) ΔH312
④2S(g)═S2(g) ΔH4
则ΔH4的正确表达式为( )发布:2024/12/6 13:30:1组卷:393引用:6难度:0.5


