化学小组同学为探究氯水的成分及性质进行了如下实验:
资料:淀粉的特征反应——遇I2变蓝色
| 实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
| 实验操作(氯水均为新制) |  |
 |
 |
 |
 |
| 实验现象 | 蒸馏水由无色逐渐变为浅黄绿色 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 产生白色沉淀 | 产生大量无色气泡 |
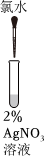
(1)证明氯水中含有Cl-的是实验
④
④
(填序号),用离子方程式表示该实验中涉及的反应 Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
、Cl-+Ag+=AgCl↓
Cl-+Ag+=AgCl↓
。(2)结合离子方程式解释实验②的现象产生的原因:
离子方程式:
Cl2+2I-=I2+2Cl-
Cl2+2I-=I2+2Cl-
。文字解释:
氯水滴入淀粉碘化钾溶液中发生氧化还原反应生成碘单质,碘单质遇到淀粉变蓝
氯水滴入淀粉碘化钾溶液中发生氧化还原反应生成碘单质,碘单质遇到淀粉变蓝
。(3)实验③中溶液变红是由于溶液中含有
H+
H+
(填微粒符号,下同);使溶液褪色的微粒是 HClO
HClO
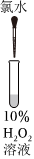
。(4)同学们根据“H2O2在催化剂作用下可发生分解”的性质,认为实验⑤中现象不一定说明氧化性Cl2>H2O2。为证实Cl2将H2O2氧化,可继续补充实验:
反应后向溶液中加入1mL 2%AgNO3溶液,产生的沉淀量明显大于实验④
反应后向溶液中加入1mL 2%AgNO3溶液,产生的沉淀量明显大于实验④
(填操作、现象)。(5)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。
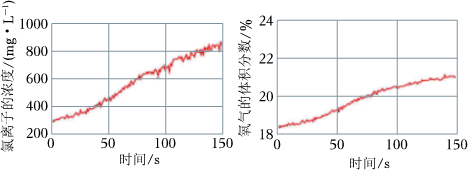
解释上两图中曲线变化的原因
由于HClO不稳定,见光受热易分解,2HClO 2HCl+O2↑,使O2体积分数增加,Cl2与水不断反应和HClO分解生成的HCl使溶液中c(Cl-)增大
光照
由于HClO不稳定,见光受热易分解,2HClO 2HCl+O2↑,使O2体积分数增加,Cl2与水不断反应和HClO分解生成的HCl使溶液中c(Cl-)增大
。若在上述整个实验过程中测定溶液的pH,pH的变化是 光照
减小
减小
(填“增大”或“减小”或“不变”)。【答案】④;Cl2+H2O=H++Cl-+HClO;Cl-+Ag+=AgCl↓;Cl2+2I-=I2+2Cl-;氯水滴入淀粉碘化钾溶液中发生氧化还原反应生成碘单质,碘单质遇到淀粉变蓝;H+;HClO;反应后向溶液中加入1mL 2%AgNO3溶液,产生的沉淀量明显大于实验④;由于HClO不稳定,见光受热易分解,2HClO 2HCl+O2↑,使O2体积分数增加,Cl2与水不断反应和HClO分解生成的HCl使溶液中c(Cl-)增大;减小
光照
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/18 10:0:2组卷:19引用:1难度:0.6



