当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:2078
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1541
更新:2025年05月26日
|
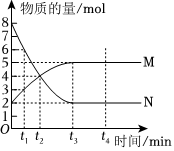 1021.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)⇌bM(g),M、N的物质的量随时间的变化曲线如图所示,下列说法错误的是( )发布:2024/12/30 14:30:1组卷:19引用:2难度:0.7
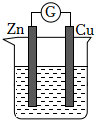
1021.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)⇌bM(g),M、N的物质的量随时间的变化曲线如图所示,下列说法错误的是( )发布:2024/12/30 14:30:1组卷:19引用:2难度:0.71022.铜-锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法错误的是( )
 发布:2024/12/30 14:30:1组卷:20引用:4难度:0.6
发布:2024/12/30 14:30:1组卷:20引用:4难度:0.61023.某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%.
(1)A的分子式为.
(2)A与溴的四氯化碳溶液混合的现象是,此变化属于变化(填物理或化学).
(3)已知: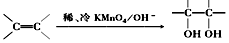 .请写出A与稀、冷的KMnO4溶液在碱性条件下生成的产物的结构简式
.请写出A与稀、冷的KMnO4溶液在碱性条件下生成的产物的结构简式
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此产物的最简式.发布:2024/12/30 14:30:1组卷:18引用:2难度:0.51024.下列有关苯的性质描述中,正确的是( )
发布:2024/12/30 14:30:1组卷:16引用:2难度:0.61025.下列反应中前者属 于取代反应。后者属于加成反应的是( )
发布:2024/12/30 14:30:1组卷:27引用:3难度:0.71026.某化学课外小组利用废铜制取硫酸铜,设计了如下制取方案,其中从理论、操作、经济、环保等方面考虑,你认为最合理的是( )
发布:2024/12/30 14:30:1组卷:29引用:3难度:0.7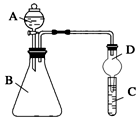 1027.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
1027.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)仪器A的名称为。
(2)实验室中现有药品:①稀盐酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固体,请选择合适药品设计实验验证 N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为、。(填序号)但有同学认为该装置有缺陷,如何改进?。发布:2024/12/30 14:30:1组卷:19引用:2难度:0.51028.在带有活塞的密闭容器中发生如下反应:Fe2O3(s)+3H2(g)
2Fe(s)+3H2O(g),采取下列措施不能改变反应速率的是( )高温发布:2024/12/30 14:30:1组卷:10引用:5难度:0.51029.某些有机化合物的模型如图所示。

回答下列问题:
(1)属于空间比例模型的是。(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)
(2)表示同一种有机化合物的是。
(3)存在同分异构体的是,写出其同分异构体的结构简式:。
(4)含碳量最低的是,含氢量最低的分子中氢元素的质量分数是。(保留三位有效数字)发布:2024/12/30 14:30:1组卷:27引用:5难度:0.6 1030.如图是硫元素的价类二维图。下列说法正确的是( )发布:2024/12/30 14:30:1组卷:27引用:2难度:0.8
1030.如图是硫元素的价类二维图。下列说法正确的是( )发布:2024/12/30 14:30:1组卷:27引用:2难度:0.8



