当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:2176
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1575
更新:2025年05月26日
|
1281.下列分子或离子中,不含孤电子对的是( )
发布:2024/12/30 12:30:1组卷:24引用:3难度:0.91282.(1)H2S分子中,两个H-S键的夹角接近90°,说明H2S分子的立体构型为
。
(2)CO2分子中,两个C=O键的夹角是180°,说明CO2分子的立体构型为。
(3)能说明CH4分子的立体构型不是平面正方形,而是正四面体形的是。(填标号,双选)
A.两个键之间的夹角为109°28'
B.C-H键为极性共价键
C.4个C-H键的键能、键长都相等
D.CH2Cl2只有一种(不存在同分异构体)发布:2024/12/30 12:30:1组卷:24引用:3难度:0.5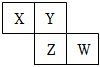 1283.如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )发布:2024/12/30 12:30:1组卷:20引用:2难度:0.9
1283.如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )发布:2024/12/30 12:30:1组卷:20引用:2难度:0.91284.写出下列原子的杂化轨道类型及分子的结构式、立体构型。
(1)CO2分子中的C原子采取杂化,分子的结构式为,立体构型呈。
(2)HCHO中的C原子采取杂化,分子的结构式为,立体构型呈。
(3)H2S分子中的S原子采取杂化,分子的结构式为,立体构型呈。发布:2024/12/30 12:30:1组卷:26引用:4难度:0.51285.下列化合物的分子中,所有原子都处于同一平面的有( )
发布:2024/12/30 12:30:1组卷:25引用:4难度:0.51286.下列物质中的碳原子的轨道杂化属于sp的是( )
发布:2024/12/30 12:30:1组卷:16引用:3难度:0.91287.有关晶体的下列说法中正确的是( )
发布:2024/12/30 12:30:1组卷:26引用:2难度:0.81288.根据价层电子对互斥模型,判断下列分子的空间结构和极性正确的是( )
选项 分子式 价层电子对互斥模型 分子或离子的空间结构 分子极性 A SO2 三角形 角形 极性 B HCHO 三角形 三角锥形 极性 C PCl3 四面体形 正三角形 非极性 D SiF4 四面体形 正四面体形 极性 发布:2024/12/30 12:30:1组卷:34引用:3难度:0.6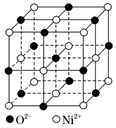 1289.高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。
1289.高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。
(1)写出基态Ni 原子的外围电子排布图。
(2)Ni 能与CO 形成配合物Ni(CO)4,配体CO 中提供孤电子对的是C 原子而不是O原子,其理由可能是;1 mol 该配合物分子中σ 键数目为(设NA 为阿伏加德罗常数的值,下同)。
(3)①的VSEPR 模型是ClO-4。
②写出与互为等电子体的一种分子:ClO-4(填化学式)。
(4)高氯酸三碳酰肼合镍化学式中的CHZ 为碳酰肼,其结构为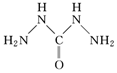 ,它是一种新型的环保锅炉水除氧剂。碳酰肼中氮原子和碳原子的杂化轨道类型分别为、。
,它是一种新型的环保锅炉水除氧剂。碳酰肼中氮原子和碳原子的杂化轨道类型分别为、。
(5)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。
①高氯酸的酸性强于次氯酸的原因是。
②如图为NiO 晶胞,则晶体中Ni2+的配位数为;若晶胞中Ni2+距离最近的O2-之间的距离为a pm,则NiO 晶体的密度=g•cm-3(用含a、NA 的代数式表示)。发布:2024/12/30 12:30:1组卷:31引用:2难度:0.51290.氯的含氧酸根离子有ClO-、
、ClO-2、ClO-3等,关于它们的说法不正确的是( )ClO-4发布:2024/12/30 12:30:1组卷:23引用:4难度:0.5



