当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:2204
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1616
更新:2025年05月26日
|
1311.(1)Cu的一种氯化物晶胞结构如图1所示(黑球表示铜原子,白球表示氯原子),该氯化物的化学式是
。若该晶体的密度为ρ g•cm-3,以NA表示阿伏加德罗常数的值,则该晶胞的边长a=nm。
(2)一种四方结构的超导化合物的晶胞如图2所示,晶胞中Sm和As原子的投影位置如图3所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=g•cm-3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(,12,12),则原子2和3的坐标分别为12、。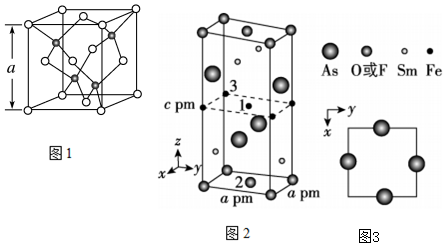 发布:2024/12/30 12:30:1组卷:26引用:6难度:0.4
发布:2024/12/30 12:30:1组卷:26引用:6难度:0.41312.下列说法不正确的是( )
发布:2024/12/30 12:30:1组卷:20引用:2难度:0.71313.已知:①CS2②PCl3③H2S(g)④CH2O⑤H3O+⑥
⑦BF3⑧SO2.请回答下列问题:NH+4
(1)中心原子没有孤电子对的是(填序号,下同)。
(2)立体构型为直线形的分子或离子有;立体构型为平面三角形的分子或离子有。
(3)立体构型为V形的分子或离子有。发布:2024/12/30 12:30:1组卷:23引用:1难度:0.61314.X、Y、Z、M、Q、R是元素周期表前四周期的元素,且原子序数依次增大,其相关信息如表所示:
(1)写出元素Q的基态原子的价电子轨道表示式是元素 相关信息 X 原子核外有6种不同运动状态的电子 Y 基态原子中s电子总数与p电子总数相同 Z 形成的氧化物和强酸、强碱都可以反应 M 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 Q 前4周期元素原子核外电子排布中未成对电子数最多的元素 R 基态原子核外有7个能级上有电子且能量最高的能级上有6个电子 。
(2)X、Y、Z三种元素的原子半径由小到大的顺序是(用元素符号表示)。
(3)M元素基态原子中能量最高的电子的电子云在空间有个伸展方向,原子轨道呈形。
(4)小范同学写了某基态原子的两个价电子的表达式,分析其分别违背了什么原理:
①3s13p4:;
②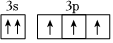 :。
:。
(5)元素R可形成R2+和R3+,其中较稳定的是R3+,从原子结构角度解释原因是。发布:2024/12/30 12:30:1组卷:35引用:2难度:0.51315.有下列八种晶体:A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.过氧化钾 H.金刚石
(1)属于原子晶体的化合物是(填序号),直接由原子构成的晶体是.直接由原子构成的分子晶体是.
(2)由分子构成的晶体是.含有共价键的离子晶体是.属于分子晶体的单质是.
(3)受热熔化化学键不发生变化的是,需克服共价键的是.发布:2024/12/30 12:30:1组卷:30引用:3难度:0.51316.下列分子的VSEPR模型与分子立体结构模型一致的是( )
发布:2024/12/30 12:30:1组卷:17引用:5难度:0.91317.下列分子或离子中,中心原子含有孤对电子的是( )
发布:2024/12/30 12:30:1组卷:18引用:5难度:0.91318.下列说法正确的是( )
发布:2024/12/30 12:30:1组卷:24引用:2难度:0.71319.下列物质所属晶体类型判断正确的是( )
发布:2024/12/30 12:30:1组卷:30引用:2难度:0.71320.价层电子对互斥理论(简称VSEPR理论)可用于预测简单分子的立体构型.其要点可以概括为:
Ⅰ.用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤电子对),(n+m)称为价层电子对数.分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间;
Ⅱ.分子的空间构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对;
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
ⅰ.孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;ⅱ.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;ⅲ.X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;ⅳ.其他.请仔细阅读上述材料,回答下列问题:
(1)根据要点Ⅰ可以画出AXnEm的VSEPR理想模型,请填写下表:
(2)请用VSEPR模型解释CO2为直线形分子的原因:n+m 2 VSEPR理想模型 正四面体形 价层电子对
之间的理想键角109°28′ ;
(3)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型:分子 或离子 SnCl2 CCl4 ClO-4立体构型 发布:2024/12/30 12:30:1组卷:22引用:4难度:0.3



