当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:1543
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1387
更新:2025年05月26日
|
161.新型钙钛矿太阳能电池具备更加清洁、便于应用、制造成本低和效率高等显著优点。 一种钙钛矿太阳能电池材料的晶胞如图1所示。请按要求回答下列有关问题
(1)构成CH3NH3+的三种元素中电负性最小的是; 写出碳原子的电子排布式为。
(2)Pb与C同主族,比C的周期序数大4,写出Pb原子最外层电子的轨道表示式(即电子排布图)。
(3)有关NH3的结构与性质探究
①NH3分子中所含化学键是(从“极性键”、“非极性键”、“配位键”、“离子键”、“σ键”或“π键”中选填符合的名称);N原子的杂化形式为。
②NH3分子的VSEPR模型名称为,分子的空间结构(即立体构型) 为。
③如图2所示,探究NH3的性质时,打开止水夹,挤压胶头滴管,可以观察到烧瓶中迅速产生红色喷泉。请用必要的分子结构与性质的知识和化学用语解释产生该现象的原因:、。
(4)该钙钛矿太阳能电池材料的化学式为;该晶胞中,与I-紧邻的I-个数为; 测定其晶体结构特征最可靠的方法是实验。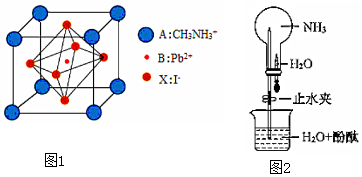 发布:2025/1/5 8:0:1组卷:85引用:1难度:0.5
发布:2025/1/5 8:0:1组卷:85引用:1难度:0.5162.根据VSEPR模型和杂化轨道理论对磷酸根(
)的空间结构的预测和解释中,完全正确的是( )PO3-4发布:2025/1/5 8:0:1组卷:6引用:1难度:0.8163.回答下列问题
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。
①NH3分子的空间结构是;N2H4分子中氮原子轨道的杂化类型是。
②肼可用作火箭燃料,燃烧时发生的反应是N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)ΔH=-1038.7kJ•mol-1,若该反应中有4molN-H断裂,则形成的π键有mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4与硫酸铵化合物类型相同,则N2H6SO4晶体不存在(填标号)。
a.离子键
b.共价键
c.范德华力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①H2Se的还原性比H2S(填“强”或“弱”)。气态SeO3分子的空间结构为,SO2的VSEPR模型为,空间结构为。
②H2O内的O-H、水分子间的范德华力和氢键,从强到弱依次为,H+可与H2O形成H3O+,H3O+中O采用杂化,H3O+中H-O-H键角比H2O中的(填“大”或“小”)发布:2025/1/5 8:0:1组卷:21引用:1难度:0.6164.下列化学用语表示或描述不正确的是( )
发布:2025/1/5 8:0:1组卷:81引用:2难度:0.7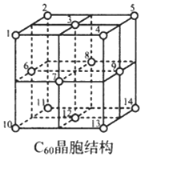 165.碳及其化合物有着重要用途。回答下列问题:
165.碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为。
(2)在CH2=CHCN中,碳原子的杂化方式有、,所含σ键数目和π键数目之比为。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小(由大到小,用H一R-H表示),其原因是。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是。
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20Å (1Å=10-8cm),则C60的晶体密度为g/cm3。
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为Å。发布:2025/1/5 8:0:1组卷:53引用:2难度:0.4166.ZnSO4溶于氨水形成[Zn(NH3)4]SO4,其中配离子[Zn(NH3)4]2+的立体构型为正四面体形。下列说法正确的是( )
发布:2025/1/5 8:0:1组卷:58引用:1难度:0.5167.下列化学用语或图示正确的是( )
发布:2025/1/5 8:0:1组卷:24引用:2难度:0.5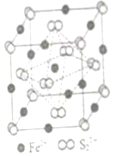 168.铁及其化合物在生产生活及科学研究方面应用非常广泛。
168.铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为;其最外层电子的电子云形状为。
(2)(NH4)2Fe(SO4)2•6H2O俗称摩尔盐
①NH4+电子式为。
②N、O两元素的第一电离能由大到小的顺序为(用元素符号表示)
③SO42-中S原子的杂化方式为,VSEPR模型名称为。
(3)K3[Fe(CN)6]晶体中中心原子的配位数为;晶体的配位体为(用化学符号表示)
(4)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为g•cm-3发布:2025/1/5 8:0:1组卷:7引用:1难度:0.7169.N、P、As都是ⅤA族元素,且原子序数依次增大,它们的单质和化合物在生产、生活中有广泛应用。请回答下列相关问题。
(1)基态磷原子的价电子排布式为。
(2)已知白磷的分子式为P4,其结构如图1所示。科学家目前合成了N4分子,其分子结构与白磷类似。则N原子的杂化轨道类型是,N-N-N键的键角为。
(3)硝酸的沸点较低,从氢键的角度推断其可能的原因是;请写出两种与NO3-互为等电子体的微粒化学式(请写一个分子和一个离子)。
(4)NO2-与钴形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是。
(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图2所示。磷化铝中,Al原子的配位数为,若最近两个Al原子之间的距离为acm,用NA表示阿伏加德罗常数的值,则该晶体的密度为g•cm-3(用含有以上字母的计算式表示)。发布:2025/1/5 8:0:1组卷:55引用:1难度:0.5170.根据杂化轨道理论和价层电子对互斥模型判断,下列说法不正确的是( )
选项 粒子 中心原子杂化方式 VSEPR模型 空间结构 A CO2 sp 直线形 直线形 B NH3 sp3 四面体形 三角锥形 C CO2-3sp2 四面体形 平面三角形 D H3O+ sp3 四面体形 三角锥形 发布:2025/1/5 8:0:1组卷:79引用:3难度:0.6



