当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
期末复习
典型试卷
考前必刷
浏览次数:2019
更新:2025年06月03日
|
 已完结
已完结
|
热点预测
高考复习
难题抢练
浏览次数:1514
更新:2025年05月26日
|
831.用化学用语表示反应Mg2Si+4HF═2MgF2+SiH4↑中的相关微粒,其中正确的是( )
发布:2024/12/30 16:0:2组卷:13引用:2难度:0.8832.如图所示是s能级和p能级的原子轨道图:

试回答下列问题。
( 1 )s电子的原子轨道呈形,每个s能级有个原子轨道;p电子的原子轨道呈形,每个p能级有个原子轨道。
(2)元素X的基态原子最外层电子排布式为nsnnpn+1,其p电子云在空间有3个互相(填“垂直”或“平行”)的伸展方向;元素X的名称是,它的最低价氢化物的电子式是。
(3)元素Y的基态原子最外层电子排布式为nsn-1npn+1,那么Y的元素符号应为,其基态原子的轨道表示式为。发布:2024/12/30 16:0:2组卷:22引用:5难度:0.7833.已知某元素原子的价电子排布式为(n-1)dansb,则下列说法正确的( )
发布:2024/12/30 16:0:2组卷:56引用:7难度:0.5834.某元素的原子L层电子数比M层电子数多5个,该元素的最高正化合价为( )
发布:2024/12/30 16:0:2组卷:18引用:3难度:0.9835.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质.
(1)写出N2H62+与碱溶液反应的离子方程式.
(2)NH2-的电子式为.
(3)N3-有个电子.
(4)写出N3-等电子体物质的化学式.(一种)
(5)等电子数的微粒往往具有相似的结构,试预测N3-的构型.
(6)据报道,美国科学家卡尔•克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键.则“N5”分子碎片所带电荷是.发布:2024/12/30 16:0:2组卷:27引用:2难度:0.3836.某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
发布:2024/12/30 16:0:2组卷:31引用:4难度:0.6837.下列大小判断正确的是( )
发布:2024/12/30 16:0:2组卷:12引用:2难度:0.7838.长式周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列.按这种规定,下列说法正确的是( )
发布:2024/12/30 16:0:2组卷:21引用:6难度:0.7839.下列有关电离能的说法,正确的是( )
发布:2024/12/30 16:0:2组卷:16引用:7难度:0.7840.某同学查阅资料得知,无水三氯化铝能催化乙醇制备乙烯,为探究适宜的反应温度,设计如图反应装置:
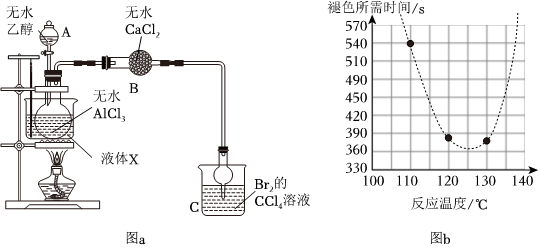
检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。完成下列填空:
(1)仪器B的名称是;该实验所采用的加热方式优点是,液体X可能是(选填编号)。
a.水
b.酒精
c.油
d.乙酸
(2)根据实验结果,判断适宜的反应温度为。
(3)在140℃进行实验,长时间反应未观察到C中溶液褪色,可能的原因是。
(4)在120℃进行实验,若将B改为装有浓硫酸的洗气瓶,长时间反应未观察到C中溶液褪色,可能的原因是。
(5)教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有、(列举两点)。
工业无水氯化铝含量测定的主要原理是:Ag++Cl-=AgCl↓。将1.400g工业无水氯化铝样品溶解后配成500mL溶液,量取25.00mL置于锥形瓶中,用浓度为0.1000mol•L-1的AgNO3标准溶液进行滴定,达到终点时消耗标准液15.30mL。
(6)该样品中AlCl3的质量分数为(保留3位有效数字)。
(7)某次测定结果误差为-2.1%,可能会造成此结果的原因是(选填编号)。
a.称量样品时少量吸水潮解
b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗
d.样品中含有少量Al(NO3)3杂质发布:2024/12/30 16:0:2组卷:33引用:3难度:0.5



