在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2═2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2═2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2═2HBr | 5.6×107 | 9.3×106 |
| I2+H2═2HI | 43 | 34 |
 (1)已知,t2>t1,HX的生成反应是
(1)已知,t2>t1,HX的生成反应是 放热
放热
反应(填“吸热”或“放热”)。(2)HX的电子式是
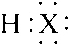
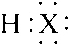
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是
HF>HCl>HBr>HI
HF>HCl>HBr>HI
。(4)X2都能与H2反应生成HX,用原子结构解释原因:
卤素原子的最外层电子数均为7,易得到电子
卤素原子的最外层电子数均为7,易得到电子
。(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:
随原子序数的增加,电子层增多
随原子序数的增加,电子层增多
,原子半径逐渐增大,得电子能力逐渐减弱。(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,
ad
ad
(填字母序号)。a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
(7)为验证ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:
①棉花中浸有NaOH溶液的作用是
Cl2+2OH-=H2O+Cl-+ClO-
Cl2+2OH-=H2O+Cl-+ClO-
(用离子方程式表示)。②验证溴与碘的非金属性强弱:通入少量氯气,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到
溶液分层,下层液体为紫红色
溶液分层,下层液体为紫红色
;该实验必须控制氯气的加入量,否则得不出溴的非金属性比碘强的结论,理由是 过量氯气可与KI反应
过量氯气可与KI反应
。【答案】放热;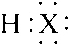 ;HF>HCl>HBr>HI;卤素原子的最外层电子数均为7,易得到电子;随原子序数的增加,电子层增多;ad;Cl2+2OH-=H2O+Cl-+ClO-;溶液分层,下层液体为紫红色;过量氯气可与KI反应
;HF>HCl>HBr>HI;卤素原子的最外层电子数均为7,易得到电子;随原子序数的增加,电子层增多;ad;Cl2+2OH-=H2O+Cl-+ClO-;溶液分层,下层液体为紫红色;过量氯气可与KI反应
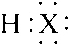 ;HF>HCl>HBr>HI;卤素原子的最外层电子数均为7,易得到电子;随原子序数的增加,电子层增多;ad;Cl2+2OH-=H2O+Cl-+ClO-;溶液分层,下层液体为紫红色;过量氯气可与KI反应
;HF>HCl>HBr>HI;卤素原子的最外层电子数均为7,易得到电子;随原子序数的增加,电子层增多;ad;Cl2+2OH-=H2O+Cl-+ClO-;溶液分层,下层液体为紫红色;过量氯气可与KI反应【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/25 8:0:9组卷:34引用:2难度:0.7
相似题
-
 1.将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)⇌2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)随温度(T)的变化如图所示,下列说法不正确的是( )发布:2024/12/19 1:30:1组卷:134引用:4难度:0.7
1.将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)⇌2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)随温度(T)的变化如图所示,下列说法不正确的是( )发布:2024/12/19 1:30:1组卷:134引用:4难度:0.7 -
2.已知:NO和O2转化为NO2的反应机理如下:
①2NO(g)⇌N2O2(g)(快) ΔH1<0 平衡常数K1
②N2O2(g)+O2(g)⇌2NO2(g)(僈) ΔH2<0 平衡常数K2
下列说法正确的是( )发布:2024/10/31 4:30:1组卷:55引用:3难度:0.8 -
3.Ⅰ.某温度下,在一个容积可变的密闭容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol和4mol,此时容器容积为4L.则此温度下该反应的平衡常数K=
.保持温度和压强不变,将各组分的物质的量都减少1mol,此时,容器的容积为,该反应的浓度商Q=.此时,平衡移动(填“向左”、“向右”或“不”)
Ⅱ.2007年度中国国家科学技术最高奖授予了石油化工催化专家闵恩泽,以表彰他在催化剂研究方面作出的突出贡献.氯化汞(HgCl2)和氯化铝(AlCl3)都有有机化工生产中常用的催化剂.
(1)氯化汞是一种能溶于水的白色固体,熔点276℃,是一种弱电解质,在水溶液中分步电离,写出其第一步电离的方程式.
氯化汞可以被氯化亚铁在溶液中还原为氯化亚汞(Hg2Cl2,白色沉淀),写出该反应的离子方程式
若该反应是一个可逆反应,写出在常温下该反应的平衡常数表达式.
(2)无水氯化铝用作石油裂解及催化重整的催化剂.能否直接加热蒸干氯化铝水溶液获得无水氯化铝?为什么?(用简要的文字叙述和必要的化学方程式说明).发布:2024/11/18 8:0:1组卷:10引用:1难度:0.3


