氨气是制备NaN3(叠氮酸钠)的原料之一,汽车安全气囊中的填充物有NaN3(叠氮酸钠)、SiO2、KNO3等物质,NaN3遇撞击时能生成金属钠和N2.
(1)下列物质中,既含有氨分子,又含有铵根离子的是 BB。
A.氨气
B.氨水
C.硝酸
D.硝酸钾
(2)PH3和NH3的某些化学性质相似.下列对晶体PH4I性质的推测,错误的是 CC。
A.PH4I是一种离子化合物
B.PH4I能与烧碱溶液反应
C.PH4I加热后会发生升华
D.PH4I溶液能与溴水反应
(3)下列有关化学用语表示正确的是 DD。
A.Ne和N3-的结构示意图均为
B.氧化钠的分子式:Na2O
C.氨气的空间填充模型:
D.NH4Br的电子式: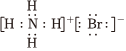
(4)用电子式表示氨气的形成过程 3H•+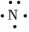 →
→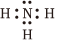 3H•+
3H•+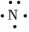 →
→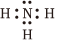 。
。
NaN3是由一种单原子离子和多原子离子以1:1的比例构成的化合物,结构式Na+[N=N=N]-。
(5)写出叠氮化钠分解的化学方程式 2NaN3 撞击 3N2↑+2Na2NaN3 撞击 3N2↑+2Na。某品牌汽车设计安全气囊受撞击时需产生44.8L气体(已换算至标准状况下的体积),则该安全气囊中需填充的NaN3质量是 81.2581.25g。
(6)汽车安全气囊填充物的三种物质中属于共价化合物的是 SiO2SiO2(填写化学式),所涉及的5种元素中,原子半径最大的是 KK(填写元素符号)。
(7)写出叠氮化钠固体中所含化学键的类型 离子键、共价键离子键、共价键。
(8)化学键是相邻原子间强烈的相互作用,主要有离子键、共价键等,有关它们叙述正确的 CC。
A.非金属元素组成的化合物中只含共价键
B.不同元素的原子构成的分子只含极性共价键
C.熔融状态下能够导电的化合物中存在离子键
D.某纯净物在常温常压下为气体,则组成该物质的微粒一定含共价键
(9)工业通过反应一:2NH3+2Na═2NaNH2+H2↑。
反应二:2NaNH2+N2O═NaN3+NaOH+NH3制备NaN3。
下列有关说法中正确的是 CDCD。
A.反应一每生成5.6L氢气,转移电子数目为0.5NA
B.反应一中NaNH2为强电解质、NH3为弱电解质
C.反应二中生成的氨气可以循环利用
D.与NaN3同为碱金属叠氮化物的LiN3受撞击分解产生Li3N和氮气,反应过程中发生了离子键和共价键的破坏与形成
SiO2、KNO3能与分解出的金属钠发生反应生成Na2SiO3,化学方程式为:Na+KNO3+SiO2→Na2SiO3+K2SiO3+N2↑(未配平)。
(10)在该反应中硝酸钾体现 氧化性氧化性(填写“氧化性”或“还原性”)。
(11)结合金属钠的化学性质,说明汽车安全气囊中填充SiO2、KNO3的目的和必要性 消耗金属钠,同时产生保护气氮气消耗金属钠,同时产生保护气氮气。
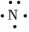 →
→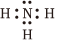
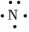 →
→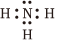
撞击
撞击
【答案】B;C;D;3H•+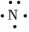 →
→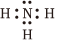 ;2NaN3 3N2↑+2Na;81.25;SiO2;K;离子键、共价键;C;CD;氧化性;消耗金属钠,同时产生保护气氮气
;2NaN3 3N2↑+2Na;81.25;SiO2;K;离子键、共价键;C;CD;氧化性;消耗金属钠,同时产生保护气氮气
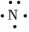 →
→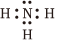 ;2NaN3
;2NaN3撞击
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/27 14:0:0组卷:41引用:1难度:0.7


