过渡金属硫化物因其独特的光电催化性能及相对稳定的化学性质而受到广泛的研究,三元金属硫化物ZnIn2S4是一种层状结构的可见光响应光催化剂。回答下列问题:
(1)基态Zn的价电子排布式为 3d104s23d104s2。Ga与In同主族,第一电离能:Zn >>Ga(填“<”、“>”或“=”)。
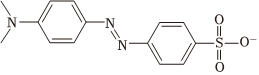
(2)指示剂甲基橙阴离子的结构如图,其中硫原子的杂化类型为 sp3sp3,该结构中含有孤电子对的原子有 N、ON、O。
(3)SO2-3的空间构型为 三角锥形三角锥形,SO2-4、SO2-3、SO3按键角从小到大的顺序排列为 SO2-3<SO2-4<SO3SO2-3<SO2-4<SO3,试解释原因 SO2-4中S原子为sp3杂化,空间构型为正四面体形,键角为109°28′,SO2-3中S原子为sp3杂化,空间构型为三角锥形,有1个孤电子对,键角小于109°28′,SO3中S原子为sp2杂化,空间构型为平面三角形,键角为120°SO2-4中S原子为sp3杂化,空间构型为正四面体形,键角为109°28′,SO2-3中S原子为sp3杂化,空间构型为三角锥形,有1个孤电子对,键角小于109°28′,SO3中S原子为sp2杂化,空间构型为平面三角形,键角为120°。
(4)Zn2+容易形成配合物,[Zn(CN)4]2-中Zn2+与CN-的碳原子形成配位键。[Zn(CN)4]2-中σ键与π键的个数之比为 1:11:1。
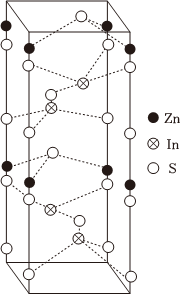
(5)ZnIn2S4晶胞结构如图,其边长为anm,高为bnm,阿伏加德罗常数的值为NA,该晶体的密度为 846a2cNA×1021846a2cNA×1021g•cm-3(列出计算式)。
SO
2
-
3
SO
2
-
4
SO
2
-
3
SO
2
-
3
SO
2
-
4
SO
2
-
3
SO
2
-
4
SO
2
-
4
SO
2
-
3
SO
2
-
4
SO
2
-
3
846
a
2
c
N
A
×
1
0
21
846
a
2
c
N
A
×
1
0
21
【答案】3d104s2;>;sp3;N、O;三角锥形;<<SO3;中S原子为sp3杂化,空间构型为正四面体形,键角为109°28′,中S原子为sp3杂化,空间构型为三角锥形,有1个孤电子对,键角小于109°28′,SO3中S原子为sp2杂化,空间构型为平面三角形,键角为120°;1:1;
SO
2
-
3
SO
2
-
4
SO
2
-
4
SO
2
-
3
846
a
2
c
N
A
×
1
0
21
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/18 8:0:8组卷:26引用:1难度:0.5
相似题
-
 1.铁及其化合物在生产生活及科学研究方面应用非常广泛。
1.铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为;其最外层电子的电子云形状为。
(2)(NH4)2Fe(SO4)2•6H2O俗称摩尔盐
①NH4+电子式为。
②N、O两元素的第一电离能由大到小的顺序为(用元素符号表示)
③SO42-中S原子的杂化方式为,VSEPR模型名称为。
(3)K3[Fe(CN)6]晶体中中心原子的配位数为;晶体的配位体为(用化学符号表示)
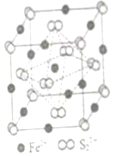
(4)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为g•cm-3发布:2025/1/5 8:0:1组卷:7引用:1难度:0.7 -
 2.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
2.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子.
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为,F的价层电子排布式为.
(2)B、C、D的电负性由大到小的顺序为(用元素符号填写),C与A形成的分子CA3的VSEPR模型为.
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是.
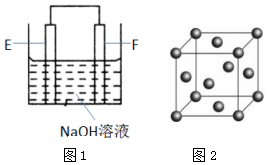
(4)以E、F的单质为电极,组成如图1所示的装置,E极的电极反应式为.
(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体.蓝色沉淀溶解的离子方程式为.
(6)F的晶胞结构(面心立方)如图2所示:已知两个最近的F的距离为acm,F的密度为g/cm3(阿伏加德罗常数用NA表示,F的相对原子质量用M表示)发布:2025/1/18 8:0:1组卷:14引用:2难度:0.5 -
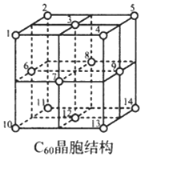 3.碳及其化合物有着重要用途。回答下列问题:
3.碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为。
(2)在CH2=CHCN中,碳原子的杂化方式有、,所含σ键数目和π键数目之比为。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小(由大到小,用H一R-H表示),其原因是。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是。
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20Å (1Å=10-8cm),则C60的晶体密度为g/cm3。
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为Å。发布:2025/1/5 8:0:1组卷:53引用:2难度:0.4


