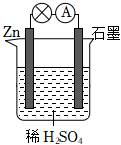
(1)高铁电池是一种新型可充电电池,其总反应式为3Zn+2K2FeO4+8H2O放电充电3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为 Zn-2e-+2OH-=Zn(OH)2Zn-2e-+2OH-=Zn(OH)2,正极附近溶液的碱性 增强增强(填“增强”、“不变”或“减弱”)。
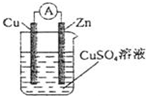
(2)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是 ③③,写出正极的电极反应式 Cu2++2e-=CuCu2++2e-=Cu,若开始时两极质量相等,当导线中通过0.05mol电子时,两个电极的质量差为 3g3g。

(3)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,甲醇(CH3OH)燃料电池的工作原理如图所示。

①该电池工作时,c入口处对应的电极为 正正(填“正”或“负”)极。
②该电池负极的电极反应式为 CH3OH-6e-+H2O=CO2+6H+CH3OH-6e-+H2O=CO2+6H+。
③工作一段时间后,当3.2g甲醇完全反应生成CO2时,外电路中通过的电子数目为 0.6NA0.6NA。(用含NA的式子表示)
放电
充电
【考点】原电池与电解池的综合.
【答案】Zn-2e-+2OH-=Zn(OH)2;增强;③;Cu2++2e-=Cu;3g;正;CH3OH-6e-+H2O=CO2+6H+;0.6NA
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/6 8:0:9组卷:28引用:1难度:0.6