海洋化学资源的综合利用对人类的发展意义重大。
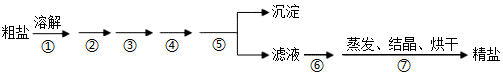
Ⅰ.食盐是日常生活的必需品,也是重要的化工原料。粗盐中常含有少量泥沙及Ca2+、Mg2+、SO2-4等杂质离子。为除去粗盐中的Ca2+、Mg2+、SO2-4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图:

(1)为除去Ca2+、Mg2+、SO2-4,按照顺序加入试剂①~③,可以是下列组合中的 BDBD(填字母)。
A.①Na2CO3②BaCl2③NaOH
B.①BaCl2②NaOH③Na2CO3
C.①NaOH②Na2CO3③BaCl2
D.①BaCl2②Na2CO3③NaOH
(2)步骤“除杂2”中涉及反应的离子方程式有:H++OH-=H2O、CO2-3+2H+=H2O+CO2↑H++OH-=H2O、CO2-3+2H+=H2O+CO2↑。
(3)粗盐提纯的整个操作过程中多处需要使用到玻璃棒,“过滤”过程中使用玻璃棒的作用是 引流引流。
Ⅱ.从海带中提取碘的工业生产过程如图:

(4)氧化剂将I-→I2。下列氧化剂中,最好选用 DD(填字母)。
A.酸性KMnO4
B.新制氯水
C.浓硫酸
D.H2O2
(5)实验室中常用CCl4从氧化后的溶液中萃取I2,其原理是 I2在CCl4中的溶解度远大于I2在水中的溶解度I2在CCl4中的溶解度远大于I2在水中的溶解度。
Ⅲ.某工厂采用如下步骤从海水中提取镁:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降,过滤,洗涤;③将沉淀物与盐酸反应,蒸发结晶,过滤,得到含结晶水的晶体;④将所得晶体在一定条件下加热得到无水氯化镁;⑤电解熔融氯化镁,得到金属镁。
(6)在以上提取镁的过程中,没有涉及的化学反应类型是 CC。
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
(7)该过程中属于氧化还原反应的化学方程式为 MgCl2 电解 Mg+Cl2↑MgCl2 电解 Mg+Cl2↑。
SO
2
-
4
SO
2
-
4
SO
2
-
4
CO
2
-
3
CO
2
-
3
电解
电解
【答案】BD;H++OH-=H2O、+2H+=H2O+CO2↑;引流;D;I2在CCl4中的溶解度远大于I2在水中的溶解度;C;MgCl2 Mg+Cl2↑
CO
2
-
3
电解
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/27 10:35:59组卷:20引用:2难度:0.7
相似题
-
1.为了除去KCl溶液中少量的MgCl2、MgSO4杂质,可选用Ba(OH)2溶液、稀盐酸和K2CO3溶液三种试剂,按图步骤操作:
溶液加过量A滤液加过量B操作Ⅰ加过量C较纯净的KCl溶液加热煮沸
(1)写出下列试剂的化学式:A,C
(2)根据题意,回答下列问题:
①加入过量A的目的是,
②加入过量B的目的是,
③加热煮沸的目的是,
(3)操作Ⅰ的名称是。发布:2024/12/14 8:0:2组卷:53引用:1难度:0.6 -
2.除去粗盐中的杂质 CaCl2、MgCl2和 Na2SO4,过程如下:

下列有关说法中,不正确的是( )发布:2024/12/30 4:0:1组卷:124引用:11难度:0.8 -
3.通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是( )
 发布:2024/12/30 4:30:1组卷:92引用:5难度:0.8
发布:2024/12/30 4:30:1组卷:92引用:5难度:0.8


