小文对氧气的性质进行了整理和归纳,并形成如图1所示的知识树。请回答相关问题:
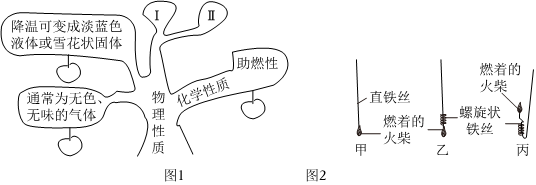
(1)氧气的物理性质的Ⅰ、Ⅱ条,分别是 密度比空气大密度比空气大、不易溶于水。
(2)氧气具有助燃性,木炭、硫、红磷、铁丝等物质都可以在氧气中燃烧。
①硫在氧气中燃烧的符号表达式为 S+O2点燃SO2S+O2点燃SO2,其生成物会导致的一种环境问题是 酸雨酸雨。
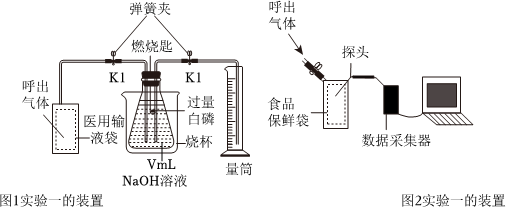
②铁丝在氧气中燃烧的现象为 剧烈燃烧,火星四射,放出热量,生成黑色固体剧烈燃烧,火星四射,放出热量,生成黑色固体。做铁丝在氧气中燃烧的实验时,集气瓶中水的作用是 防止高温熔融物溅落,使集气瓶底炸裂防止高温熔融物溅落,使集气瓶底炸裂。如图2所示甲、乙、丙三种方式中,你认为最容易使实验成功的是 乙乙。
(3)小文在了解氧气的性质后,对呼出的气体中主要成分及含量非常好奇,设计如下实验进行探究。
【提出问题】呼出气体中有哪些主要成分,它们的含量是多少?
【查阅资料】
①呼出气体中仍含有O2;
②白磷和红磷具有相似的化学性质,都可燃,都不能与氢氧化钠溶液反应;
③二氧化碳可以被足量的氢氧化钠溶液吸收,反应时无明显现象;
④被液体浸泡后的白磷,只要与氧气接触且温度达到40℃仍然可以燃烧。
【猜想与实验】猜想:呼出的气体中主要成分是N2、O2、CO2等;
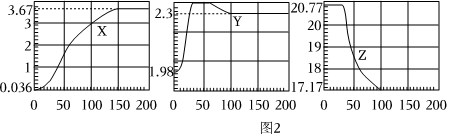
实验一:验证呼出的气体中主要成分是N2、O2、CO2,并测定其含量。同学们在老师的指导下设计了如图1所示装置。
【实验记录】
点燃
点燃
| 实验操作 | 主要实验现象 | 实验结论及解释 |
| ①检查装置的气密性,向装置中加入药品。 | 装置气密性良好 | |
| ②先将锥形瓶中装满氢氧化钠溶液,打开弹簧夹K1、K2,将医用输液袋内的500mL呼出气体压入锥形瓶中。关闭K1、K2,并冷却至室温。 | 锥形瓶中液面下降,原来空的量筒进入482mL液体。 | 呼出的气体中CO2的体积为 18 18 mL。 |
| ③此时,锥形瓶中氢氧化钠溶液的液面低于燃烧匙,再往烧杯中倒入80℃的热水。 |
产生大量白烟,放出热量 产生大量白烟,放出热量
|
呼出的气体中,含N2 396 396 mL,含O286 86 mL。 |
| ④待白磷熄灭并冷却到室温,打开K2。 | 量筒中部分液体倒吸入锥形瓶中;量筒中剩余液体为396mL。 |
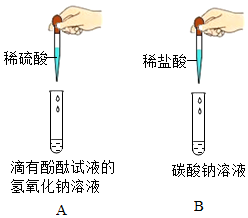
(1)表示O2体积分数变化的曲线是
Z
Z
(填“X”、“Y”或“Z”);(2)Y曲线在约为60s时逐渐下降,后趋于稳定。推测食品包装袋内可能看到的现象是
保鲜袋内壁有水雾
保鲜袋内壁有水雾
;【实验反思】
(1)实验一设计依据的N2性质有
ACD
ACD
(填选项序号);A、难溶于水
B、无色无味
C、不和氢氧化钠溶液反应
D、不能燃烧,也不支持燃烧
(2)实验一的实验操作④中,若锥形瓶中气体未完全冷却就打开K2并读数,则所测氮气的体积分数将
偏大
偏大
(填“偏小”、“不变”或“偏大”)。【答案】密度比空气大;S+O2SO2;酸雨;剧烈燃烧,火星四射,放出热量,生成黑色固体;防止高温熔融物溅落,使集气瓶底炸裂;乙;18;产生大量白烟,放出热量;396;86;Z;保鲜袋内壁有水雾;ACD;偏大
点燃
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/1 5:0:10组卷:21引用:1难度:0.5
相似题
-
 1.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
1.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
(1)米、面的主要成分都是由三种元素组成的淀粉,淀粉属于糖类.
(2)水瓶内的水垢主要成分是碳酸钙,可用(填一种调味品)除去.
(3)白糖与红糖主要成分都是蔗糖.利用活性炭的性,可将红糖脱色成白糖.
(4)市场上销售的香肠、盐水鸭、榨菜、豆腐干等食品,常采用真空包装,其目的是防止食品而变质.
(5)味精是烹制菜肴时常用的调味品,小明研究某品牌味精包装上的部分文字说明后,想测定此味精中氯化钠的含量.
[查阅资料]NaCl+AgNO3=AgCl↓+NaNO3,谷氨酸钠的存在不影响NaCl性质.
[实验过程]
①称取该味精样品10.0g,并溶于蒸馏水
②加入过量的硝酸银溶液,过滤
③用蒸馏水反复洗涤沉淀多次
④将沉淀烘干、称量,测得固体质量为5.74g
根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器除烧杯、铁架台(带铁圈)、玻璃棒外,还需要的玻璃仪器是.
②试通过计算确定此样品中NaCl质量分数与其包装上标注的含量是否相符.发布:2025/1/6 8:0:1组卷:68引用:2难度:0.5 -
2.化学兴趣小组同学们在老师的指导下对市售某品牌“钙片”的补钙原理、成分以及功效展开了项目化学习的探究。
【查阅资料】
(1)该补钙剂的主要成分有碳酸钙、维生素D3、硫酸锌、水果香料等。
(2)维生素D3、水果香料都不溶于水也不与酸反应,维生素D3主要作用是促进人体对钙的吸收。
项目一:探究“钙片”补钙原理。
【分析交流】
“钙片”中钙以碳酸钙形式存在,“钙片”进入胃首先要通过人体胃酸对其进行溶解后方可被吸收。
【进行实验】
【反思评价】服用“钙片”时,采用实验方案 实验现象 实验结论或化学方程式 取适量“钙片”粉末于试管中,滴加足量 。化学方程式 (填“吞服”或“嚼服”)的服药方式更有利促进胃肠吸收。
项目二:探究“钙片”中是否含有硫酸锌。
项目三:探究“钙片”的功效。实验方案 实验现象 实验结论 另取少量“钙片”粉末于试管中,加足量水,充分溶解,取适量上层清液于试管中,加入几滴 。“钙片”中含有硫酸锌。
【交流讨论】
该补钙剂适用于中老年人治疗因缺钙导致的患者。老师建议大家应注意平时的饮食补钙,牛奶、鱼类等食物除富含营养素外,是较好的补钙食物,应该多食用。发布:2025/1/3 16:0:5组卷:30引用:1难度:0.5 -
 3.酸、碱、盐种类繁多,与人类生活和生产关系密切。请回答下列问题:
3.酸、碱、盐种类繁多,与人类生活和生产关系密切。请回答下列问题:
(1)造纸业会产生大量含NaOH的碱性废水,需经处理至中性排放。
①写出NaOH的俗称:(一个即可)。
②若某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸9.8t(H2SO4的质量分数为10%)。可以处理的废水质量为t。
(2)某化学兴趣小组做了如图所示的两个实验。完成A、B两个实验后,同学们将实验后的废液倾倒入一个废液缸中,发现废液呈红色,小组同学对废液成分展开了如下探究。(该题实验过程中所用溶液浓度较低;氯化钙溶液和氯化钡溶液显中性;实验中如涉及硫酸钙、氢氧化钙等微溶物,均可看做可溶物)
【交流讨论】小组同学经讨论分析后一致认为废液中一定含有的溶质有氯化钠和(酚酞除外)。
【提出猜想】废液中还含有的物质:
猜想一:NaOH;
猜想二:Na2CO3;
猜想三:(填化学式)。
【实验验证】
甲同学取少量废液于试管中,向其中加入过量的氯化钙溶液,通过观察现象,得出了正确结论。若猜想二正确,甲同学观察到的现象:有白色沉淀生成,;请写出发生反应的化学方程式:。
【交流与反思】乙同学认为,将甲同学实验中的氯化钙溶液换成氯化钡溶液,也能得出正确结论。你认为乙同学的观点是否正确并说明你的理由:。发布:2025/1/3 8:0:1组卷:93引用:1难度:0.5


