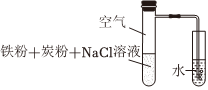
铁的腐蚀与防护与生产生活密切相关。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002mol/LCuSO4溶液中浸泡,过滤后用水洗涤
步骤2:向15.00mL1mol/LNaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉
步骤3:采集溶液pH随时间变化的数据。
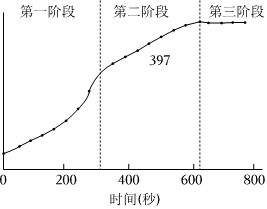
(1)第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为 2H++2e-=H2↑2H++2e-=H2↑。
(2)第二、三阶段主要发生吸氧腐蚀
①选取b点进行分析:经检验溶液中含有Fe2+,写出Fe被腐蚀的总反应 2Fe+O2+4H+=2Fe2++2H2O2Fe+O2+4H+=2Fe2++2H2O。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。b点Fe2+被氧化的离子方程式为 4Fe2++O2+4H+=4Fe3++2H2O4Fe2++O2+4H+=4Fe3++2H2O。
③依据b点发生的反应,分析第二阶段pH升高的原因是 相同时间内,铁被氧化为Fe2+消耗H+的量大于Fe2+被氧化为产生H+的量相同时间内,铁被氧化为Fe2+消耗H+的量大于Fe2+被氧化为产生H+的量。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:Zn2+放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的 负极负极相连。
②向ZnSO4电解液中加入NaCN溶液,将Zn2+转化为[Zn(CN)4]2-,电解得到的镀层更加致密、细腻,原因是 通过反应Zn2++4CN-=[Zn(CN)4]2-,降低了c(Zn2+),使得Zn2+放电速率减慢,同时通过平衡的移动补充放电消耗的Zn2+,使其浓度保持相对稳定,达到放电速率平稳的作用通过反应Zn2++4CN-=[Zn(CN)4]2-,降低了c(Zn2+),使得Zn2+放电速率减慢,同时通过平衡的移动补充放电消耗的Zn2+,使其浓度保持相对稳定,达到放电速率平稳的作用。
(4)电镀后的废水中通常含有CN-,用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是 ABCABC。
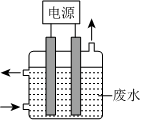
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O
C.阴极的电极反应式为:2H2O+2e-═H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O
【答案】2H++2e-=H2↑;2Fe+O2+4H+=2Fe2++2H2O;4Fe2++O2+4H+=4Fe3++2H2O;相同时间内,铁被氧化为Fe2+消耗H+的量大于Fe2+被氧化为产生H+的量;负极;通过反应Zn2++4CN-=[Zn(CN)4]2-,降低了c(Zn2+),使得Zn2+放电速率减慢,同时通过平衡的移动补充放电消耗的Zn2+,使其浓度保持相对稳定,达到放电速率平稳的作用;ABC
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/12 10:0:1组卷:28引用:1难度:0.6