学习酸碱中和反应时,同学们发现稀盐酸与氢氧化钠溶液混合在一起无明显现象。学习小组的同学们对其产生探究兴趣,于是他们分别从不同的角度探究酸碱中和反应。
【探究一】通过pH变化的角度,证明酸碱发生中和反应。化学兴趣小组同学对稀盐酸和氢氧化钠溶液反应的发生进行了探究。
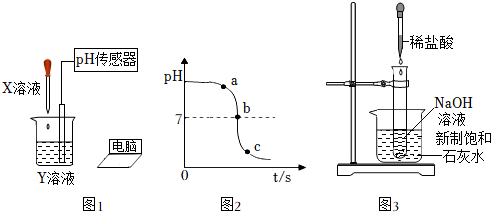
(1)利用如图1所示的装置进行实验探究。用pH传感器测得烧杯中溶液的pH随滴加液体体积变化的曲线如图2所示。
①反应前烧杯中盛放的液体Y是 氢氧化钠溶液氢氧化钠溶液。
②图中b点所示溶液中的溶质是 氯化钠氯化钠。
③写出盐酸和氢氧化钠反应的化学方程式:HCl+NaOH=NaCl+H2OHCl+NaOH=NaCl+H2O。
(2)利用如图3所示装置进行实验:烧杯中放入新制饱和石灰水,向试管中加入氢氧化钠溶液,将稀盐酸滴入试管。一段时间后,试管外壁附近溶液中出现浑浊,原因是 盐酸和氢氧化钠反应放热,而氢氧化钙的溶解度随温度升高而减小盐酸和氢氧化钠反应放热,而氢氧化钙的溶解度随温度升高而减小。
【探究二】通过能量变化的角度,证明酸碱发生中和反应。
(3)毛毛同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论,牛牛同学认为毛毛同学推理不合理,理由是 氢氧化钠固体溶解放热氢氧化钠固体溶解放热。
(4)牛牛同学为了验证毛毛同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化如图4①所示:
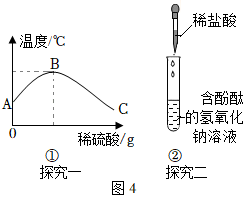
①由图4①知,稀硫酸与氢氧化钠溶液发生的反应是 放热放热(填“放热”或“吸热”)反应。
②从A到B过程中,烧杯中溶液pH逐渐 减小减小,到达C时溶液中溶质有 硫酸钠和硫酸硫酸钠和硫酸。
【探究三】通过溶液酸碱性变化的角度,证明酸碱发生中和反应。
(5)娇娇同学利用图4②实验进行反应,证明碱与酸发生反应的现象是 溶液由红色变为无色溶液由红色变为无色。
(6)明明同学观察到实验过程中有气泡产生,他认为氢氧化钠溶液已经变质,请你分析变质的原因(用化学方程式表示) 2NaOH+CO2=Na2CO3+H2O2NaOH+CO2=Na2CO3+H2O。
【探究四】通过证明有新物质生成的角度,证明酸碱发生中和反应。
为验证中和反应有水生成,萌萌同学在老师的指导下,查阅了相关资料,进行如图5所示的三个实验。
已知:①变色硅胶吸水后由蓝色变为红色。②无水醋酸与氢氧化钠反应生成醋酸钠和水。
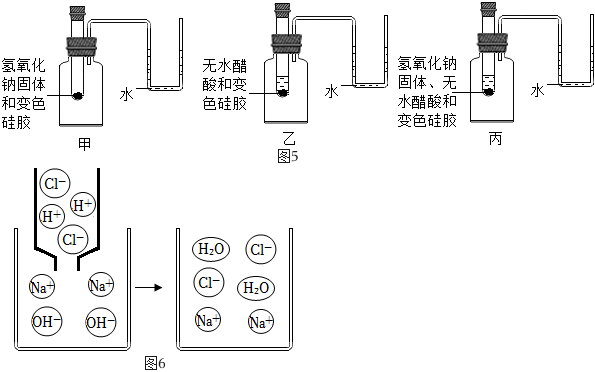
(7)证明无水醋酸与氢氧化钠反应有水生成的现象是 甲、乙中硅胶不变色,丙中硅胶由蓝色变为红色甲、乙中硅胶不变色,丙中硅胶由蓝色变为红色。
(8)实验过程中,观察到丙的U形管内液面 左低右高左低右高。
【探究五】从微观角度(图6)认识酸碱中和反应的本质是 H++OH-=H2OH++OH-=H2O。
【考点】中和反应及其应用;溶液的酸碱性与pH的关系.
【答案】氢氧化钠溶液;氯化钠;HCl+NaOH=NaCl+H2O;盐酸和氢氧化钠反应放热,而氢氧化钙的溶解度随温度升高而减小;氢氧化钠固体溶解放热;放热;减小;硫酸钠和硫酸;溶液由红色变为无色;2NaOH+CO2=Na2CO3+H2O;甲、乙中硅胶不变色,丙中硅胶由蓝色变为红色;左低右高;H++OH-=H2O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/8 8:0:9组卷:171引用:1难度:0.5
相似题
-
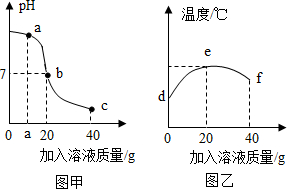 1.某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图甲所示,溶液的温度变化如图乙所示(不考虑反应过程中热量损失)。下列说法错误的是( )发布:2024/12/25 17:0:2组卷:71引用:3难度:0.6
1.某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图甲所示,溶液的温度变化如图乙所示(不考虑反应过程中热量损失)。下列说法错误的是( )发布:2024/12/25 17:0:2组卷:71引用:3难度:0.6 -
 2.小明同学用如图所示的方法做酸碱中和实验,采用酚酞试液作指示剂,恰好完全中和时溶液的颜色为( )发布:2024/12/25 17:0:2组卷:68引用:3难度:0.9
2.小明同学用如图所示的方法做酸碱中和实验,采用酚酞试液作指示剂,恰好完全中和时溶液的颜色为( )发布:2024/12/25 17:0:2组卷:68引用:3难度:0.9 -
3.某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验.下列选项正确的是( )
选项 所用试剂 现象和结论 A 硫酸铜溶液 出现蓝色沉淀,则氢氧化钠过量 B 氯化钡溶液 出现白色沉淀,则硫酸过量 C 铜丝 有气泡产生,则硫酸过量 D 无色酚酞溶液 溶液不变色,则恰好完全反应 发布:2024/12/25 17:30:2组卷:46引用:2难度:0.7


