CO2与人类息息相关。近年来,为了缓解温室效应,CO2的资源化利用是化学研究热点之一。科学家提出了多种回收和利用CO2的方案。
(1)人体血液中存在平衡CO2+H2O⇌H2CO3⇌H++HCO-3,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:失去二氧化碳太多,促进平衡向逆反应方向移动,氢离子浓度减小,氢氧根浓度增大,引发碱中毒失去二氧化碳太多,促进平衡向逆反应方向移动,氢离子浓度减小,氢氧根浓度增大,引发碱中毒。
(2)利用CO2制备CH4可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2molCO2和8molH2发生反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示,回答下列问题:

①下列说法正确的是 BCBC。
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2molC=O键的同时断开4molC-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度小于1.6mol/L
②从反应开始到10min,H2的平均反应速率v(H2)=0.32mol/(L•min)0.32mol/(L•min)。
③300℃时,反应的平衡常数K=2525。
④500℃该反应达到平衡时,上述容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O。则ΔH4<<0(填“>”“<”或“=”)
(3)化工废水中常常含有以二甲胺[(CH3)2NH]为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。

反应原理是:(i)Cl-在阳极转化为Cl2;
(ii)Cl2在碱性溶液中歧化为ClO-;
(iii)ClO-将二甲胺氧化为N2,CO2-3和H2O。
①写出电解池中阴极发生反应的方程式 2H2O+2e-=2OH-+H2↑;2H2O+2e-=2OH-+H2↑;。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是 需要阴极区产生的OH-迁移到阳极区,维持阳极区的碱性需要阴极区产生的OH-迁移到阳极区,维持阳极区的碱性。
③当阴极区收集到6.72L(标况下)H2时,阳极区收集到N2的体积(标况下)是 0.4480.448L。
HCO
-
3
CO
2
-
3
【答案】失去二氧化碳太多,促进平衡向逆反应方向移动,氢离子浓度减小,氢氧根浓度增大,引发碱中毒;BC;0.32mol/(L•min);25;<;2H2O+2e-=2OH-+H2↑;;需要阴极区产生的OH-迁移到阳极区,维持阳极区的碱性;0.448
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/21 8:0:9组卷:105引用:2难度:0.5
相似题
-
1.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
2.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。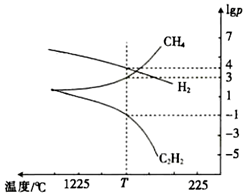
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


