碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。
(1)已知:CO(g)+2H2(g)═CH3OH(g) ΔH=-90.8kJ•mol-1。该反应的熵变ΔS <<0(填“>”“<”“=”),该反应自发进行的条件是 低温低温(填“低温”“高温”或“任意温度”)。
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,所涉及的反应方程式为:CO2(g)+4H2(g)═CH4(g)+2H2O(g) ΔH=-270kJ•mol-1,几种化学键的键能如表所示:
| 化学键 | C―H | H―H | O―H | C=O |
| 键能/kJ•mol-1 | 414 | 436 | 464 | a |
749kJ•mol-1
749kJ•mol-1
。(3)利用电化学原理,将CO2还原为CH4,装置如图所示:
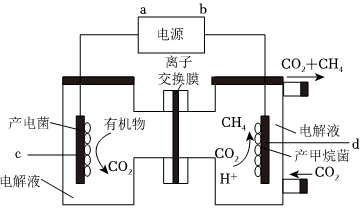
①d电极的电极反应式为
CO2+8e-+8H+=CH4+2H2O
CO2+8e-+8H+=CH4+2H2O
.②若电源采用CH3OH―O2―KOH清洁燃料电池,当消耗0.2mol燃料CH3OH时,离子交换膜中通过
1.2
1.2
molH+,该清洁燃料电池中的a极的电极反应式为 O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
。(4)T℃时,向容积为2L的恒容密闭容器中通入3.0molCO2和6.5molH2,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49kJ•mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
①在0~5min内容器中v(H2)=
0.45mol•L-1•min-1
0.45mol•L-1•min-1
。②该温度下上述反应的平衡常数K=
0.75
0.75
。③下列措施能增大反应速率的是
AD
AD
(填字母)。A.升高温度
B.扩大容器体积
C.充入一定量氦气
D.加入催化剂
【答案】<;低温;749kJ•mol-1;CO2+8e-+8H+=CH4+2H2O;1.2;O2+4e-+2H2O=4OH-;0.45mol•L-1•min-1;0.75;AD
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/18 8:0:2组卷:13引用:1难度:0.5