某小组同学探究FeCl3溶液显黄色的原因。
资料:i.FeCl3溶液中存在平衡:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5(OH)]2++H3O+。
ii.Fe3+与NO-3不能形成配位键。
(1)Fe3+的核外电子排布式为 3d53d5。
[猜想与预测]
小组同学认为可能是Fe3+与其他微粒配位形成的配离子导致溶液显黄色,进而提出以下猜想:
Ⅰ.Fe3+与OH-配位
Ⅱ.Fe3+与H2O配位
Ⅲ.Fe3+与Cl-配位
(2)解释Fe3+可与这些微粒形成配合物的原因:Fe3+提供空轨道,OH-、H2O、Cl-提供孤对电子Fe3+提供空轨道,OH-、H2O、Cl-提供孤对电子。
[实验与分析]
为验证猜想Ⅰ,小组同学设计并完成了以下实验。
-
3
| 实验 | a | b | c |
| 实验操作 | 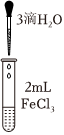 |
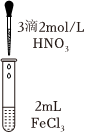 |
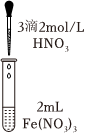
|
| 实验现象 | 溶液黄色略变浅 | 溶液黄色略变浅 | 黄色褪去 |
控制Fe3+浓度相同
控制Fe3+浓度相同
。(4)①甲同学认为实验c可以证明猜想Ⅰ成立,而猜想Ⅱ不成立,理由是
滴加3滴2mol/L硝酸,观察到溶液黄色褪去,说明:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5(OH)]2++H3O+,平衡逆向移动
滴加3滴2mol/L硝酸,观察到溶液黄色褪去,说明:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5(OH)]2++H3O+,平衡逆向移动
。小组同学为了证明猜想Ⅲ成立,将实验c所得溶液分为两份进行了实验:| 实验 | d | e |
| 实验操作 |
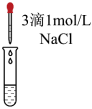
|
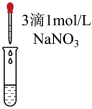
|
| 实验现象 | 溶液仍为无色 |
溶液由无色变为黄色
溶液由无色变为黄色
,证明猜想Ⅲ成立。[结论与反思]
(5)依据上述现象解释FeCl3溶液显黄色的原因是
Fe3+与OH-配位和Fe3+与Cl-配位
Fe3+与OH-配位和Fe3+与Cl-配位
。(6)已知EDTA与Fe配位能力比SCN-更强,设计实验证明Fe3+与EDTA形成的配合物为浅黄色(EDTA通常配成溶液使用):
向2mLFeCl3(pH 约为2)溶液中滴入3滴KSCN溶液,溶液变血红色;继续滴加3滴EDTA溶液,溶液由血红色变为浅黄色
向2mLFeCl3(pH 约为2)溶液中滴入3滴KSCN溶液,溶液变血红色;继续滴加3滴EDTA溶液,溶液由血红色变为浅黄色
。【答案】3d5;Fe3+提供空轨道,OH-、H2O、Cl-提供孤对电子;控制Fe3+浓度相同;滴加3滴2mol/L硝酸,观察到溶液黄色褪去,说明:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5(OH)]2++H3O+,平衡逆向移动;溶液由无色变为黄色;Fe3+与OH-配位和Fe3+与Cl-配位;向2mLFeCl3(pH 约为2)溶液中滴入3滴KSCN溶液,溶液变血红色;继续滴加3滴EDTA溶液,溶液由血红色变为浅黄色
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/6 8:0:9组卷:23引用:1难度:0.6
相似题
-
1.在液氨中投入金属钠,迅速溶剂化得到蓝色电子液[Na+(NH3)x和e-(NH3)y]且过程中有少量H2产生。下列说法正确的是( )
发布:2025/1/4 8:0:1组卷:22引用:3难度:0.6 -
2.ZnSO4溶于氨水形成[Zn(NH3)4]SO4,其中配离子[Zn(NH3)4]2+的立体构型为正四面体形。下列说法正确的是( )
发布:2025/1/5 8:0:1组卷:58引用:1难度:0.5 -
3.Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)Pt(NH3 )2 Cl2是平面正方形结构,还是四面体结构.
(2)请画出这两种固体分子的几何构型图,淡黄色固体:. 黄绿色固体:.
(3)淡黄色固体物质是由分子组成,黄绿色固体物质是由分子组成(填“极性分子”或“非极性分子”)发布:2024/12/30 17:0:2组卷:75引用:3难度:0.1


