合成氨工业对人类社会的发展具有里程碑式意义。
(1)工业常用CH4与H2O高温下制合成氨的原料气H2,1molCH4完全转化为CO2时理论能制得H2的物质的量为 4mol4mol。
(2)等离子体合成氨使用H2O代替H2作为氢源,模拟制备原理如图所示,在高压电场作用下,N2与H2O以一定流速通过反应器,主要得到NH3与HNO2(弱酸),气体流出反应器后,经过一定长度的导管进入成分分析装置。
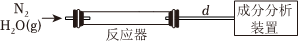
①等离子体合成氨反应的化学方程式为 N2+2H2O 高温 NH3+HNO2N2+2H2O 高温 NH3+HNO2。
②成分分析表明,连接反应器与成分分析装置的导管的长度d越长,测得气体中NH3与HNO2的含量越低,其原因可能是 氨气与亚硝酸发生反应生成NH4NO2氨气与亚硝酸发生反应生成NH4NO2。
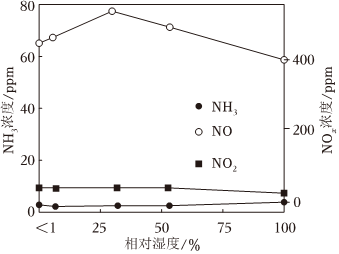
③若将原料气中N2替换为空气,反应器流出气体中NH3及NOx浓度随原料气相对湿度(水蒸气含量)的变化如图所示,流出气体中NH3的浓度几乎为0的原因可能是 空气中含有氧气和氮气,在高压下生成NO而不生成NH3,对NH3选择性降低空气中含有氧气和氮气,在高压下生成NO而不生成NH3,对NH3选择性降低。
高温
高温
【考点】化学方程式的有关计算;工业制氨气.
【答案】4mol;N2+2H2O NH3+HNO2;氨气与亚硝酸发生反应生成NH4NO2;空气中含有氧气和氮气,在高压下生成NO而不生成NH3,对NH3选择性降低
高温
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/3 8:0:9组卷:54引用:1难度:0.5
相似题
-
1.钢铁是最重要、用量最大的金属材料之一.完成下列计算:
(1)生产1吨含铁96%的生铁,至少需要氧化铁含量70%的赤铁矿(杂质不含铁)吨.(计算结果保留2位小数)
(2)工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2 FeO+CO→Fe+CO2
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物.通过计算确定此固体可能的成分和它们的物质的量之比.
(3)为了测定某碳素钢(假设只含铁和碳)的含碳量,将10.000g钢样完全溶解于过量的热浓硝酸中,产生了0.300mol气体(假设气体全部逸出,N2O4已折算为NO2).气体用50.00mL 12.00mol/L的NaOH溶液完全吸收后,只生成两种盐,溶液蒸干后得到不含结晶水的固体32.664g.计算:
(1)钢样的含碳量.
(2)参加反应的硝酸的物质的量.发布:2025/1/9 8:0:2组卷:75引用:1难度:0.1 -
2.清洁能源,即绿色能源,它包括核能和“可再生能源”。其中可再生能源包括:水力发电、风力发电、太阳能、生物能(沼气)、地热能、海潮能等这些能源。生物能(沼气)的主要成分是甲烷(CH4),现有甲烷的质量为3.2g,请计算(写出简要计算过程):
(1)该甲烷在标准状况下的体积为多少L?
(2)使该甲烷充分燃烧,需要O2的物质的量是多少?发布:2025/1/25 8:0:2组卷:7引用:1难度:0.7 -
3.乙醇、乙二醇(HOCH2CH2OH)、甘油(丙三醇HOCH2CHOHCH2OH)分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
发布:2024/12/30 19:0:1组卷:87引用:2难度:0.7


