氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).
现有0.001mol•L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液.反应的离子方程式是2MnO4-+5HSO3-+H+═2Mn2++5SO42-+3H2O.请完成下列问题:
(1)本实验不需要不需要(填“需要”或“不需要”)使用指示剂,理由是Mn2+无色,MnO4-为紫色,过量的MnO4-使无色溶液变为紫色Mn2+无色,MnO4-为紫色,过量的MnO4-使无色溶液变为紫色.
(2)该滴定实验所需仪器有下列中的A、D、E、F(G、H)A、D、E、F(G、H).
A.酸式滴定管(50mL) B.碱式滴定管(50ml) C.量筒(10ml) D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(3)不用碱碱(填“酸”或“碱”)式滴定管盛放酸性KMnO4溶液,试分析原因
酸性KMnO4溶液具有强氧化性,能腐蚀橡胶管酸性KMnO4溶液具有强氧化性,能腐蚀橡胶管.
(4)滴定前平视KMnO4溶液液面,刻度为aml,滴定后俯视液面刻度为bml,则(b-a)ml比实际消耗KMnO4溶液体积少少(填“多”或“少”),如果滴定后仰视液面刻度为cml,计算得到的待测液浓度比实际浓度大大(填“大”或“小”).
(5)取Ce(OH)4产品0.5000g,加硫酸溶解后,用0.100 0mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗20.00mL标准溶液,该产品中Ce(OH)4的质量分数为_83.20%83.20%.
【考点】中和滴定.
【答案】不需要;Mn2+无色,MnO4-为紫色,过量的MnO4-使无色溶液变为紫色;A、D、E、F(G、H);碱;酸性KMnO4溶液具有强氧化性,能腐蚀橡胶管;少;大;83.20%
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/17 4:0:1组卷:18引用:3难度:0.3
相似题
-
1.下列实验方法或操作正确的是( )
发布:2024/12/12 8:0:1组卷:9引用:1难度:0.7 -
2.下面关于中和滴定的实验操作叙述不正确的有( )
①将锥形瓶用蒸馏水和待测定的盐酸溶液进行洗涤
②取20mL待测定的盐酸溶液,注入锥形瓶中
③向锥形瓶中加入几滴酚酞试液为指示剂
④碱式滴定管用蒸馏水洗涤后,直接注入已知浓度的NaOH溶液
⑤进行中和滴定时,一旦锥形瓶内溶液由无色变成粉红色,即可停止滴定
⑥记录数据,进行必要的数据处理和得出结论发布:2024/12/10 0:30:1组卷:94引用:2难度:0.7 -
3.食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL,实验室用标准NaOH溶液测定食醋中醋酸的浓度,以检测食醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示,请回答:
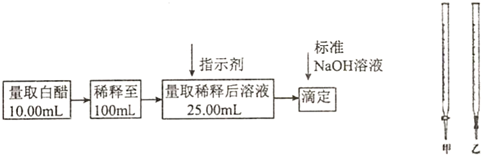
(1)选用上述(填“甲”或“乙”)滴定管量取10.00mL白醋后,将白醋稀释至100mL时,需要使用的玻璃仪器有烧杯、玻璃棒和.
(2)某同学用酸碱中和滴定法测定该品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中=c(CH3COOH)c(CH3COO-),则此时溶液中的pH=11.8×103.(已知:室温下醋酸的Ka=1.8×10-5)
(3)根据该同学的计算结果,应该选作指示剂.(填“酚酞”、“甲基橙”或“石蕊”)
(4)该滴定达到终点时的现象是.
(5)某次实验滴定开始和结束时,碱式滴定管中的液面如下图所示,则所用NaOH溶液的体积为mL.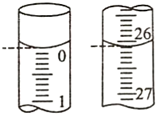
(6)用标准的0.06000mol⋅L-1NaOH溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:
则该品牌白醋中醋酸含量为滴定次数 待测溶液的体积/mL 标准溶液的体积 滴定前刻度/mL 滴定后刻度/mL 1 25.00mL 0.02 25.01 2 25.00mL 0.70 25.71 3 25.00mL 0.50 24.2 mg/mL.
(7)下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是.(填编号)
A.取待测液的滴管,取液前滴定管尖嘴处无气泡,取液后尖嘴处出现气泡
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
D.读取NaOH溶液体积时,开始时俯视读数,滴定结束时仰视读数
(8)有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,现把管内液体全部放出,用量筒接收,得到溶液的体积是.
A.等于10mL
B.等于40mL
C.大于40mL
D.不能确定发布:2024/12/30 3:0:4组卷:54引用:2难度:0.6


