电池的种类繁多,应用广泛,根据电化学原理回答下列问题:
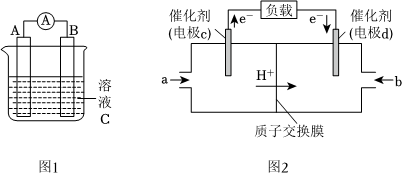
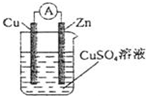
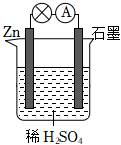
(1)图1中,若溶液C为稀H2SO4,电流表指针发生偏转,B电极材料为Zn且作负极,则A电极上发生的电极反应式为 2H++2e-=H2↑2H++2e-=H2↑;反应进行一段时间后溶液酸性将 减弱减弱(填“增强”“减弱”或“基本不变”)。
(2)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池的结构示意图如图2,电池总反应为C2H5OH+3O2=2CO2+3H2O,则d电极是 正极正极(填“正极”或“负极”),c电极的电极反应式为 C2H5OH-12e-+3H2O=2CO2↑+12H+C2H5OH-12e-+3H2O=2CO2↑+12H+。若线路中转移4mol电子,则上述C2H5OH燃料电池消耗的O2在标准状况下的体积为 22.422.4L。
(3)一种熔融碳酸盐燃料电池的原理示意图如图。请回答下列问题:
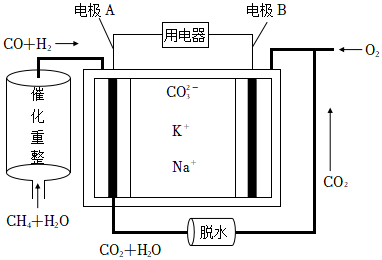
①反应CH4+H2O 催化剂 △3H2+CO,每消耗1molCH4理论上转移的电子数目为 6NA6NA。
②电池工作时,CO2-3向电极 AA(填“A”或“B”)移动。
③电极B上发生的电极反应为 O2+2CO2+4e-=2CO2-3O2+2CO2+4e-=2CO2-3。
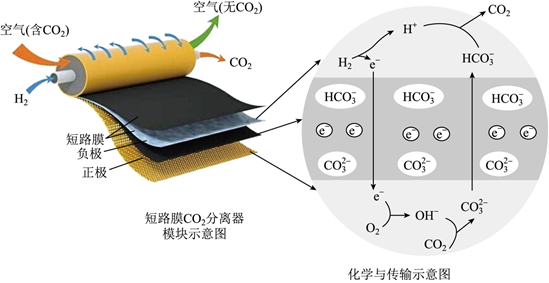
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示:
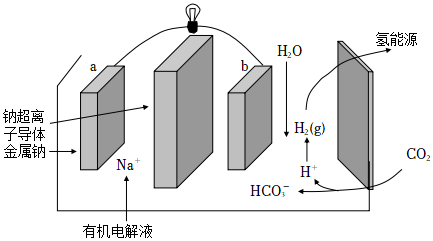
①系统工作时,a极为 负负极,b极区的电极反应式为 2CO2+2H2O+2e-=2HCO-3+H22CO2+2H2O+2e-=2HCO-3+H2。
②系统工作时b极区有少量固体析出,可能的原因是 Na+移向正极,结合HCO-3形成NaHCO3,NaHCO3溶解度不大,可能析出Na+移向正极,结合HCO-3形成NaHCO3,NaHCO3溶解度不大,可能析出。
催化剂
△
CO
2
-
3
CO
2
-
3
CO
2
-
3
HCO
-
3
HCO
-
3
HCO
-
3
HCO
-
3
【考点】原电池与电解池的综合.
【答案】2H++2e-=H2↑;减弱;正极;C2H5OH-12e-+3H2O=2CO2↑+12H+;22.4;6NA;A;O2+2CO2+4e-=2;负;2CO2+2H2O+2e-=2+H2;Na+移向正极,结合形成NaHCO3,NaHCO3溶解度不大,可能析出
CO
2
-
3
HCO
-
3
HCO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/20 8:0:8组卷:80引用:1难度:0.6