碱式碳酸锰[Mn2(OH)2CO3]是一种不溶于水的固体,是制造其他含锰化合物的原料。工业上以方锰矿(主要成分为MnO,还含有少量的Fe3O4、Al2O3、CaO、SiO2)为原料制备碱式碳酸锰。
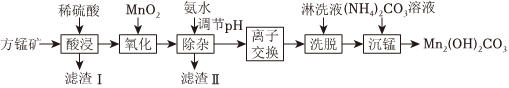
25℃时,相关物质的Ksp如表:
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| Ksp | 2×10-13 | 5×10-17 | 3×10-39 | 1×10-32 | 6×10-6 |
SiO2、CaSO4
SiO2、CaSO4
(填化学式)。(2)“氧化”时,该反应的离子方程式为
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
。(3)“除杂”时,使用氨水的目的是将Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥
5
5
;若Al3+沉淀完全时,则溶液中Fe3+物质的量浓度为 3×10-12
3×10-12
mol•L-1。(通常认为溶液中的离子浓度≤1×10-5mol•L-1沉淀完全)(4)“离子交换”和“洗脱”时,发生反应:Mn2++2HR⇌MnR2+2H+(HR是氢型交换树脂)。为了提高“洗脱”效率,淋洗液应为
酸
酸
(填“硫酸”、“氢氧化钠溶液”或“蒸馏水”)。(5)“沉锰”时,反应的离子方程式为
3+2Mn2++2H2O=Mn2(OH)2CO3↓+2
CO
2
-
3
HCO
-
3
3+2Mn2++2H2O=Mn2(OH)2CO3↓+2
,过滤、洗涤、干燥,得到Mn2(OH)2CO3,检验沉淀是否洗涤干净的操作是 CO
2
-
3
HCO
-
3
取最后一次洗涤液少许于试管中,加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸放置于试管口处,试纸不变蓝色,证明洗涤干净
取最后一次洗涤液少许于试管中,加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸放置于试管口处,试纸不变蓝色,证明洗涤干净
。(6)为测定产品中锰的含量,取ag样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量0.1000mol•L-1(NH4)2S2O8溶液将锰元素转化为
M
n
O
-
4
①滴定终点的现象是
滴入最后半滴硫酸亚铁标准液,溶液紫色褪去,且半分钟内不恢复原色
滴入最后半滴硫酸亚铁标准液,溶液紫色褪去,且半分钟内不恢复原色
。②产品中锰的质量分数为
1
.
1
V
a
1
.
1
V
a
【答案】SiO2、CaSO4;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;5;3×10-12;酸;3+2Mn2++2H2O=Mn2(OH)2CO3↓+2;取最后一次洗涤液少许于试管中,加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸放置于试管口处,试纸不变蓝色,证明洗涤干净;滴入最后半滴硫酸亚铁标准液,溶液紫色褪去,且半分钟内不恢复原色;%
CO
2
-
3
HCO
-
3
1
.
1
V
a
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/30 0:0:8组卷:28引用:2难度:0.3
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质)。用该烧渣制取药用辅料-红氧化铁的工艺流程如下:
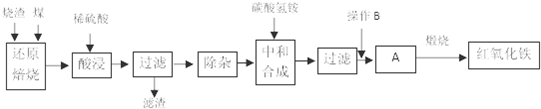
(1)在“还原焙烧”中产生的有毒气体可能有。
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示)。
(3)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是。
(4)煅烧A的反应方程式是。
(5)ag烧渣经过上述工艺可得红氧化铁bg。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示)。发布:2025/1/19 8:0:1组卷:30引用:1难度:0.5 -
2.我国青藏高原的盐湖中蕴藏着丰富的锂资源,已探明的储量约三千万吨,碳酸锂制备高纯金属锂的一种工艺流程如图。下列有关说法错误的是( )
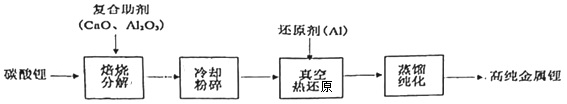 发布:2025/1/6 7:30:5组卷:28引用:2难度:0.9
发布:2025/1/6 7:30:5组卷:28引用:2难度:0.9 -
3.查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
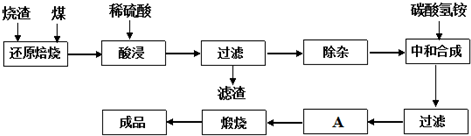
(1)焙烧时产生的主要有害气体是.
(2)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验Fe3+已经除尽的试剂是(除KSCN外).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.1


