数字传感器的诞生,极大地方便了化学实验研究,现用如图装置,进行一系列实验探究。

【设计实验】
实验一:检查装置的气密性
(1)传感器Ⅰ、Ⅱ分别是温度传感器和压强传感器。用注射器吸取20ml水,将水全部推入三颈烧瓶并压住活塞,若 压强传感器的读数增大且保持不变压强传感器的读数增大且保持不变则装置气密性良好。
实验二:探究CO2与NaOH溶液能否发生反应
传感器Ⅰ、Ⅱ分别是pH传感器和压强传感器。三颈烧瓶中充满CO2气体,注射器中装少量pH为13.8的NaOH溶液,将溶液全部推入三颈烧瓶并压住活塞,实验结果:A.压强数值先变大后变小;B.溶液pH持续变小,最终定格在8.3。
(2)能确定CO2气体和NaOH溶液发生了化学反应的实验结果为 BB(用序号A、B选填)。
(3)此NaOH溶液若全部生成Na2CO3溶液pH应该为11.5左右。由此可知,本实验中Na2CO3又反应生成了NaHCO3,生成NaHCO3的化学方程式为 Na2CO3+H2O+CO2=2NaHCO3Na2CO3+H2O+CO2=2NaHCO3。
【拓展延伸】装置如图1、图2,甲瓶中充满二氧化碳,乙中是水,实验前K关闭。

(4)图1装置甲中仪器a的名称 分液漏斗分液漏斗。
(5)将装置甲中胶头滴管中的浓NaOH溶液挤入瓶中,振荡;打开装置甲中K,观察到乙中的现象是 导管口有气泡冒出导管口有气泡冒出,原因是 甲中二氧化碳与氢氧化钠反应生成碳酸钠和水,甲中的二氧化碳被消耗,导致瓶内压强减小,空气进入乙瓶中甲中二氧化碳与氢氧化钠反应生成碳酸钠和水,甲中的二氧化碳被消耗,导致瓶内压强减小,空气进入乙瓶中。接着将装置甲仪器a中的稀盐酸注入甲中,先无气泡后产生气泡,观察到乙中的现象是 长玻璃管内液面上升长玻璃管内液面上升。
(6)为了充分证明二氧化碳与氢氧化钠能发生反应,某同学设计了图2所示的实验方案,则装置丁中X试剂含有的溶质为 NaOHNaOH和 BaCl2BaCl2(填化学式),装置丙的作用是 证明二氧化碳与氯化钡不反应证明二氧化碳与氯化钡不反应。
实验三:探究稀盐酸与NaOH溶液的中和反应
传感器Ⅰ、Ⅱ分别是pH传感器和温度传感器。三颈烧瓶装溶液X,注射器装溶液Y,将溶液Y缓缓推入三颈烧瓶并压住活塞,以推入溶液Y的体积为横坐标,绘制了图3、图4。

(7)溶液Y是 稀盐酸稀盐酸溶液,恰好完全反应时消耗Y溶液 1212mL。
(8)b点到c点,溶液温度降低的原因是 b点后反应完全,不再放热,溶液温度逐渐降低b点后反应完全,不再放热,溶液温度逐渐降低。
实验四:定量探究影响铁锈蚀的因素
已知:碳粉可加快铁锈蚀,碳粉不与盐酸反应。
传感器Ⅰ、Ⅱ分别是温度传感器和压强传感器,将5g某型号铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2ml饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上(此时没有推动注射器活塞),采集数据。

(9)据图5,说明铁生锈是 放热放热(填“放热”或“吸热”),t2~t3这段时间反应并未停止但温度却开始降低,原因是 铁生锈放出的热量小于热量的散失铁生锈放出的热量小于热量的散失。
(10)据图6分析t3时刻后压强突然变大,原因是 铁生锈消耗氧气,使得三颈瓶内压强变小,注射器中的稀盐酸被吸入三颈瓶内与铁接触发生反应产生氢气,使瓶内压强迅速变大铁生锈消耗氧气,使得三颈瓶内压强变小,注射器中的稀盐酸被吸入三颈瓶内与铁接触发生反应产生氢气,使瓶内压强迅速变大。
【拓展延伸】:测定部分生锈的铁粉中铁的含量
(11)连接如图7装置。取部分生锈的铁粉(铁和氧化铁的混合物)0.6g于锥形瓶中,加入足量稀盐酸进行实验。完全反应后,立即读出生成气体体积为0.2L,已知该条件下氢气密度为0.09g/L,根据以上数据,请列式计算该固体中铁的质量分数。

【反思评价】
(12)学习小组有同学提出:用这种方法测得的气体体积不够准确,可能会会导致测定的铁的质量分数变大,可能的原因是 BDBD(填序号)。
A.装置的气密性不好
B.铁与盐酸反应放热
C.生成的气体会部分滞留在锥形瓶中
D.没有扣掉加入的盐酸的体积
【答案】压强传感器的读数增大且保持不变;B;Na2CO3+H2O+CO2=2NaHCO3;分液漏斗;导管口有气泡冒出;甲中二氧化碳与氢氧化钠反应生成碳酸钠和水,甲中的二氧化碳被消耗,导致瓶内压强减小,空气进入乙瓶中;长玻璃管内液面上升;NaOH;BaCl2;证明二氧化碳与氯化钡不反应;稀盐酸;12;b点后反应完全,不再放热,溶液温度逐渐降低;放热;铁生锈放出的热量小于热量的散失;铁生锈消耗氧气,使得三颈瓶内压强变小,注射器中的稀盐酸被吸入三颈瓶内与铁接触发生反应产生氢气,使瓶内压强迅速变大;BD
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/12 8:0:9组卷:125引用:3难度:0.3
相似题
-
1.化学兴趣小组的同学在进行酸和碱的性质探究时,进行了图一、图二、图三等三个实验:
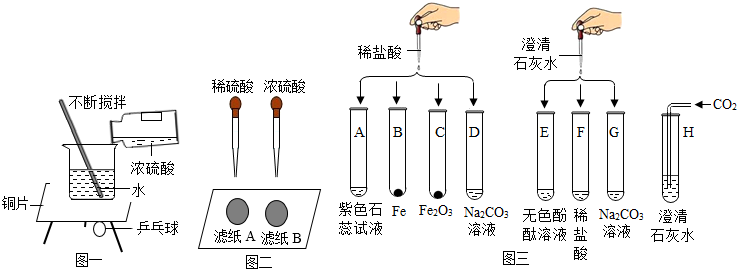
(1)【实验一】浓硫酸稀释过程中的能量变化。
图一实验中,观察到用石蜡固定在铜片下的乒乓球脱落,说明浓硫酸稀释时(填“吸热”或“放热”)
(2)【实验二】溶液浓度对硫酸化学性质的影响。
图二实验中,观察到很快变黑的是滤纸(填“A”或“B”),由此可知,硫酸溶液的浓度不同,性质不同。
(3)【实验三】探究盐酸和氢氧化钙的化学性质,取8支试管分别用A-H编号后,做如图三的实验。
①实验中观察到有气泡生成的试管是(填编号);
②试管C中反应的化学方程式为。
③实验后某试管中为红色溶液,当向其中加入过量的澄清石灰水后,溶液变为蓝色。由此推断,该试管是。(填编号)
④H试管的反应常用来检验二氧化碳,请写出反应的化学方程式。
⑤E、F、G试管实验完成后,将试管内清液都倒入同一只洁净的大烧杯中,发现有白色沉淀生成,上层清液呈无色。上层清液中溶质的成分除酚酞外一定有,可能还有。发布:2024/12/25 12:0:1组卷:96引用:5难度:0.5 -
2.某化学兴趣小组的同学利用实验室器材进行了实验探究

[实验一]如图1是实验室常用的几种实验装置,请回答下列问题:
(1)写出实验室用AE装置组合制取某种气体的化学方程式,用E装置收集该气体,气体从(填“a”或“b”)端进入。
(2)实验室制取的CO2中常含有少量杂质气体会干扰F实验的目的。为排除干扰,除去该杂质并检验是否除净,将产生的混合气体依次通过上述装置(在B至E中选择,填序号,装置不重复),再进入F装置:F装置内产生的现象为。
[实验二]探究酸碱中和反应。利用图2装置进行实验,实验开始后将注射器内的液体逐滴注入烧瓶内。
(1)实验测得烧杯中溶液的pH随时间的变化关系如图3所示,c点所示溶液加热蒸干所得固体是(填化学式)。
(2)该反应是放热反应,对应图3中点温度最高。
(3)能说明盐酸和氢氧化钠发生化学反应的依据是:
①溶液的颜色从红色变为无色;②溶液的pH。
[实验三]探究NaOH和CO2的反应。
(1)从压强变化的角度探究。
①利用图4装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强(填“大于”或“小于”)外界大气压;
②利用图5装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是。
(2)利用“数字化实验”探究。利用图6装置进行实验,实验过程中装置内压强变化如图7所示,a点时推入NaOH溶液,b点时推入稀盐酸。
①ab段对应反应的化学方程式;
②bc段压强不变的原因是;
③证明CO2与NaOH溶液发生反应的实验现象是。发布:2024/12/25 16:30:1组卷:156引用:2难度:0.3 -
3.在实验课上,同学们将CO2通入到Ca(OH)2溶液中观察到有白色沉淀生成,而将CO2通入到NaOH溶液中无明显现象。
【提出问题】CO2与NaOH溶液是否发生了化学反应?
【提出猜想】CO2与NaOH溶液发生了化学反应
【实验探究】小明设计出了下列4种实验装置,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低。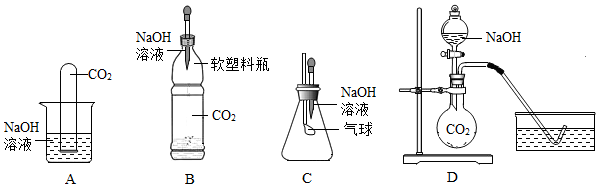
(1)实验现象为:A中试管内液面上升,B中,C中,D中水槽中的水部分进入烧瓶。
(2)小宁对小明的方案提出了质疑,他认为小明的实验不严谨,其理由是要得到科学严谨的结论,利用方案A,补做的对比实验是。
(3)小丽的改进方案是利用反应后的溶液来验证猜想,请完成实验报告。
【得出结论】CO2与NaOH溶液发生了化学反应,请写出CO2与NaOH反应的化学方程式:实验操作 实验现象 实验结论 向实验后的溶液
中加入稀盐酸猜想正确 。发布:2024/12/25 11:0:2组卷:73引用:3难度:0.1


