化学小组用双液原电池原理研究酸碱性对物质氧化性、还原性强弱的影响。通过改溶液酸碱性,观察电压表读数的变化,读数越大,则对应物质的氧化性(或还原性)越强。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
②MnO-4的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为Mn2+;在中性和弱碱性溶液中,被还原为MnO2;在强碱性溶液中,被还原为MnO2-4。
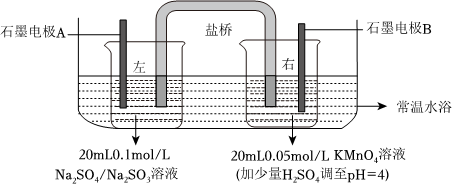
(1)连接电压表,形成闭合回路,测得初始电压为V1。实验装置要置于水浴内的原因:保证溶液的温度不变,防止对实验造成干扰保证溶液的温度不变,防止对实验造成干扰。
实验操作和读数记录如下:
M
n
O
-
4
M
n
O
2
-
4
| 左烧杯(Na2SO4/Na2SO3) | 右烧杯(KMnO4,调pH=4) | 电压表读数变化 | |
| ① | 逐滴加入5mL0.05mol/LH2SO4 | 由V1逐渐降低 | |
| ② | 逐滴加入5mL0.1mol/LNaOH | 由V1逐渐升高 | |
| ③ | 逐滴加入5mL0.05mol/LH2SO4 | 由V1逐渐升高 | |
| ④ | 加入少量0.1mol/LNaOH | 由V1略微下降 | |
| 继续逐滴加入NaOH至5mL | 再迅速下降 |
溶液碱性增强,Na2SO3的还原性增强
溶液碱性增强,Na2SO3的还原性增强
。(3)同学乙认为实验①中,加入酸后,还原剂转化成了
NaHSO3
NaHSO3
(填化学式)。(4)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入
5mL的蒸馏水或加入5mL0.05mol/LNa2SO4
5mL的蒸馏水或加入5mL0.05mol/LNa2SO4
,测得电压为V2,以此作为实验①②的初始电压。(5)同学丁认为,实验③加入5mLH2SO4溶液后,右边烧杯内的电极反应为:
M
n
O
-
4
M
n
O
-
4
实验④加入5mLNaOH溶液后,右边烧杯内的电极反应为:
M
n
O
-
4
M
n
O
2
-
4
M
n
O
-
4
M
n
O
2
-
4
【考点】原电池原理.
【答案】保证溶液的温度不变,防止对实验造成干扰;溶液碱性增强,Na2SO3的还原性增强;NaHSO3;5mL的蒸馏水或加入5mL0.05mol/LNa2SO4;+8H++5e-=Mn2++4H2O;+e-=
M
n
O
-
4
M
n
O
-
4
M
n
O
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/25 1:0:1组卷:38引用:1难度:0.5
相似题
-
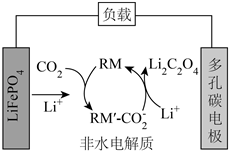 1.我国某科研团队借助氧化还原介质RM,将Li-CO2电池的放电电压提高至3V以上,该电池的工作原理如图。下列说法正确的是( )发布:2024/12/20 4:30:1组卷:156引用:2难度:0.5
1.我国某科研团队借助氧化还原介质RM,将Li-CO2电池的放电电压提高至3V以上,该电池的工作原理如图。下列说法正确的是( )发布:2024/12/20 4:30:1组卷:156引用:2难度:0.5 -
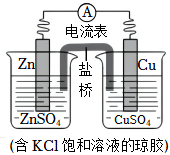 2.铜锌原电池的装置如图,其中盐桥为内含KCl的琼脂凝胶,下列说法不正确的是( )发布:2024/12/15 19:30:1组卷:195引用:1难度:0.5
2.铜锌原电池的装置如图,其中盐桥为内含KCl的琼脂凝胶,下列说法不正确的是( )发布:2024/12/15 19:30:1组卷:195引用:1难度:0.5 -
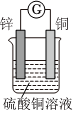 3.如图所示将锌、铜通过导线相连,置于硫酸铜溶液中。
3.如图所示将锌、铜通过导线相连,置于硫酸铜溶液中。
(1)该装置将转化为能。
(2)Zn电极为极,发生反应,电极方程式为。
(3)外电路电子由电极经导线流向电极。
(4)若反应过程中锌溶解了6.5g,则铜电极增重g,该回路中转移的电子数为。发布:2024/12/30 3:0:4组卷:313引用:2难度:0.7


