为验证“2Fe3++2I-⇌2Fe2++12”是可逆反应,进行以下实验。
【试剂】
| 试剂 | Fe2(SO4)3溶液0.005mol•L-1 | KI溶液0.01mol•L-1 | KI溶液1mol•L-1 |
| 颜色 | 浅黄色 | 无色 | 无色 |
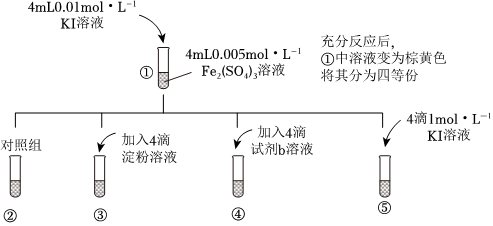
(1)③中出现的实验现象是
溶液变蓝色
溶液变蓝色
,④中加入试剂b KSCN
KSCN
(填化学式)溶液后,溶液颜色变红。由③、④可得结论:在该条件下充分反应后,反应物与生成物仍能同时存在,即可说明该反应是可逆反应。(2)⑤中出现的实验现象是
棕黄色加深
棕黄色加深
。请用化学平衡移动原理解释⑤中现象产生的原因是 溶液中存在2Fe3++2I-⇌2Fe2++12平衡,加入1mol•L-1KI溶液后,I-浓度增大,平衡正向移动
溶液中存在2Fe3++2I-⇌2Fe2++12平衡,加入1mol•L-1KI溶液后,I-浓度增大,平衡正向移动
。由此可得结论:若改变反应条件可以出现平衡移动现象,即可说明该反应是可逆反应。【实验Ⅱ】
(3)如图所示的原电池装置,a、b均为石墨电极。闭合开关K后,检流计指针向右偏转,b发生的电极反应式是
Fe3++e-=Fe2+
Fe3++e-=Fe2+
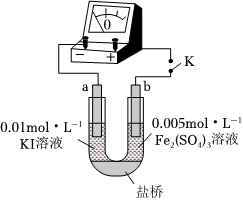
(4)当指针归零后,向U型管左管中滴加少量0.01mol/LAgNO3溶液。产生的现象是
检流计指针向左偏转
检流计指针向左偏转
。此时,b发生的电极反应式是 Fe2+-e-=Fe3+
Fe2+-e-=Fe3+
。在该装置中,改变反应条件出现了平衡移动的现象,说明该反应是可逆反应。(5)通过以上实验,可以证实“2Fe3++2I-⇌2Fe2++12”是可逆反应。以下事实能说明该反应达到化学平衡状态的是
abc
abc
(填字母)。a.①中各物质浓度不再改变
b.⑤中溶液颜色不再改变
c.实验Ⅱ中检流计指针归零
【答案】溶液变蓝色;KSCN;棕黄色加深;溶液中存在2Fe3++2I-⇌2Fe2++12平衡,加入1mol•L-1KI溶液后,I-浓度增大,平衡正向移动;Fe3++e-=Fe2+;检流计指针向左偏转;Fe2+-e-=Fe3+;abc
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/25 0:0:1组卷:13引用:1难度:0.7


