(1)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

①电极X的材料是 CuCu;电解质溶液Y是 硝酸银硝酸银;
②银电极为电池的 正正极,发生的电极反应式为 Ag++e-=AgAg++e-=Ag;
③外电路中的电子是从 铜铜电极流向 银银电极。
(2)如图所示,甲、乙为相互串联的两个电解池。

①甲池为粗铜的精炼装置,A电极为 阴阴(填“阳极”或“阴极”),电极材料是 精铜精铜,电解质溶液可以是 含Cu2+的溶液(如CuSO4溶液)含Cu2+的溶液(如CuSO4溶液),电极反应为 Cu2++2e-=CuCu2++2e-=Cu。
②乙池中Fe极的电极反应式是 2H2O+2e-=H2↑+2OH-2H2O+2e-=H2↑+2OH-,若在乙池中滴入少量酚酞溶液,电解一段时间后,Fe极附近呈 红红色。
【考点】设计原电池;原电池与电解池的综合.
【答案】Cu;硝酸银;正;Ag++e-=Ag;铜;银;阴;精铜;含Cu2+的溶液(如CuSO4溶液);Cu2++2e-=Cu;2H2O+2e-=H2↑+2OH-;红
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/27 10:35:59组卷:23引用:2难度:0.7
相似题
-
 1.某小组在验证反应“Fe+2Ag+=Fe2++2Ag”,实验探究过程如下。结合探究过程回答下列问题。
1.某小组在验证反应“Fe+2Ag+=Fe2++2Ag”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的0.05mol⋅L-1硝酸银溶液中(忽略Ag+的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有Fe3+,可以选用的试剂为(填化学式)溶液。Fe3+产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生Fe3+。
假设b:空气中存在O2,Fe2+被氧化为Fe3+,写出反应的离子方程式:。
假设c:酸性溶液中的具有氧化性,可产生Fe3+。NO-3
(2)某同学证明上面假设c不成立,向硝酸酸化的硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无Fe3+。
(3)取过滤后的黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag。
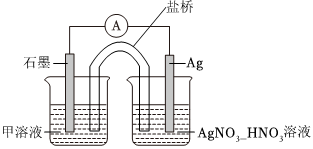
(4)某同学利用原电池证明Ag+可以将Fe2+氧化为Fe3+,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除O2)。甲溶液中的溶质为。写出石墨电极上发生的电极反应式:。电流表指针不再偏转后,向左侧烧杯中加入FeCl3固体,发现电流表指针反向偏转,此时石墨电极为(填“正极”或“负极”),银电极的电极反应式为。发布:2024/10/12 6:0:3组卷:98引用:4难度:0.5 -
2.某电池总反应为Fe+2Fe3+=3Fe2+,下列与此电池总反应不符的原电池是( )
发布:2024/12/13 10:30:1组卷:210引用:3难度:0.8 -
3.(1)某蓄电池的正负极标志难以辨别,请设计实验方案,将蓄电池的正负极辨别出来
。
(2)解释下列化学反应的反应速率变化关系曲线
①将除去氧化膜的镁条投入盛有稀盐酸的试管中,产生氢气的速率随时间的变化关系如图A所示,试解释原因:。
②过氧化氢在酶的催化作用下的分解速率随温度的变化关系如图B所示,试解释原因:。
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。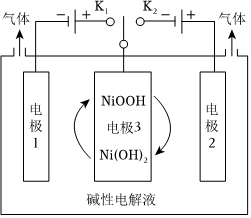
①制H2时,连接。
②改变开关连接方式,可得O2,电极反应式为。
③结合①和②中电极3的电极反应式,说明电极3的作用:。
(4)甲醇燃料电池DMFC可作电脑、汽车的能量来源。在实验室完成一个实验,用DMFC电解NaClO3溶液可制取NaClO4溶液,装置如图所示(其中DMFC以KOH作电解质)。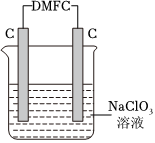
①写出电源负极电极反应式:。
②写出电解的总反应化学方程式:。发布:2024/9/14 4:0:8组卷:27引用:1难度:0.5


