我国是世界上最早冶炼锌的国家之一,有独立的炼锌发展史。在现代工业中,锌在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点420℃,沸点907℃。
Ⅰ.如图是古代以炉甘石(ZnCO3)为原料炼锌的示意图:

(1)泥罐内的主要反应为:
i.ZnCO3(s)═ZnO(s)+CO2(g)ΔH1
ii.CO2(g)+C(s)═2CO(g)ΔH2
••••••
总反应:ZnCO3(s)+2C(s)═Zn(g)+3CO(g)ΔH3
利用ΔH1和ΔH2计算ΔH3时,还需要利用 C(s)+ZnO(s)=Zn(g)+CO(g)C(s)+ZnO(s)=Zn(g)+CO(g)反应的ΔH。
(2)c处收集到 液液(填“固”“液”或“气”)态金属锌。a和b两处小孔位于相反的位置,目的是 使锌蒸气充分冷凝为液态锌使锌蒸气充分冷凝为液态锌。
(3)通过观察b处火焰可确定罐内反应状态。正常时,火焰应呈蓝色,燃烧的物质主要是 COCO。当火焰呈蓝绿色(Zn的焰色)时,可采取的措施是 在b处对蒸气再次进行冷凝回流在b处对蒸气再次进行冷凝回流。
Ⅱ.现代炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2)为原料联合生产锌和高纯度二氧化锰的一种流程如图:

(4)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
i:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
ii:••••••
①写出ii的离子方程式:ZnS+2Fe3+=Zn2++2Fe2++SZnS+2Fe3+=Zn2++2Fe2++S。
②下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b. 向a中红色溶液,加入ZnS,振荡,红色褪去向a中红色溶液,加入ZnS,振荡,红色褪去。
(5)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是 通入空气时,发生反应4Fe2++O2+6H2O=4FeOOH+8H+,溶液的pH减小,加入的ZnO发生反应ZnO+2H+=Zn2++H2O,可控制溶液的pH通入空气时,发生反应4Fe2++O2+6H2O=4FeOOH+8H+,溶液的pH减小,加入的ZnO发生反应ZnO+2H+=Zn2++H2O,可控制溶液的pH。
(6)电解:总反应(未配平):Zn2++Mn2++H2O 电解 Zn+MnO2+H+。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?Mn2+Mn2+(填“Zn2+”、“Mn2+”或“都不需要”)。
电解
【答案】C(s)+ZnO(s)=Zn(g)+CO(g);液;使锌蒸气充分冷凝为液态锌;CO;在b处对蒸气再次进行冷凝回流;ZnS+2Fe3+=Zn2++2Fe2++S;向a中红色溶液,加入ZnS,振荡,红色褪去;通入空气时,发生反应4Fe2++O2+6H2O=4FeOOH+8H+,溶液的pH减小,加入的ZnO发生反应ZnO+2H+=Zn2++H2O,可控制溶液的pH;Mn2+
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/29 8:0:9组卷:34引用:1难度:0.3
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
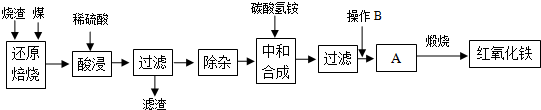
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
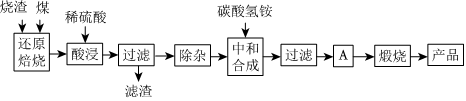
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
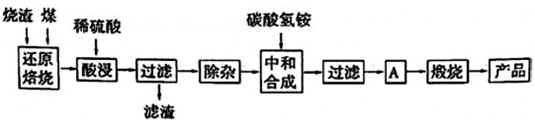
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


