MnO2是重要的化工原料,由软锰矿制备MnO2的一种工艺流程如图:

资料:①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | Al3+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨。目的是
增大反应物接触面积,加快Mn2+溶出速率
增大反应物接触面积,加快Mn2+溶出速率
。②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

③步骤Ⅱ是从软锰矿中溶出Mn2+白的主要反应,反应的离子方程式是
MnO2+4H++2Fe2+═Mn2++2Fe3++2H2O
MnO2+4H++2Fe2+═Mn2++2Fe3++2H2O
。b.若Fe2+全部来自于反应Fe+2H+═Fe2++H2,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2。而实际比值小于2,原因是
2Fe3++Fe=3Fe2+,Fe2+循环使用
2Fe3++Fe=3Fe2+,Fe2+循环使用
。(2)纯化的目的是为了除去溶液中的杂质。已知:溶液pH越小,MnO2的氧化性越强。纯化时先加入
MnO2
MnO2
,后加入 氨水
氨水
(选填“氨水”、“MnO2”)。调溶液pH 4.7
4.7
~5.8
5.8
,调pH到此范围的目的是 将Al3+、Fe3+沉淀除去
将Al3+、Fe3+沉淀除去
。(3)电解。Mn2+纯化液经电解得MnO2。生成MnO2的电极反应式是
Mn2+-2e-+2H2O=MnO2+4H+
Mn2+-2e-+2H2O=MnO2+4H+
。(4)产品纯度测定。向0.45g产品中加入1.34gNa2C2O4和足量稀硫酸,加热至充分反应。再用0.1000mol•L-1KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为20.00mL。已知:MnO2+C2
O
2
-
4
M
n
O
-
4
O
2
-
4
滴定过程中MnO2、KMnO4得电子,Na2C2O4失电子,根据电子守恒有2n(MnO2)+5n(KMnO4)=2n(Na2C2O4),即2n(MnO2)=2×-5×0.1000mol•L-1×0.0200L=0.0100mol,n(MnO2)=0.0050mol,n(MnO2)=nM=0.0050mol×87g/mol=0.4350g,产品的纯度为×100%≈96.67%
1
.
34
g
134
g
/
mol
0
.
4350
g
0
.
45
g
滴定过程中MnO2、KMnO4得电子,Na2C2O4失电子,根据电子守恒有2n(MnO2)+5n(KMnO4)=2n(Na2C2O4),即2n(MnO2)=2×-5×0.1000mol•L-1×0.0200L=0.0100mol,n(MnO2)=0.0050mol,n(MnO2)=nM=0.0050mol×87g/mol=0.4350g,产品的纯度为×100%≈96.67%
。(写出计算过程)1
.
34
g
134
g
/
mol
0
.
4350
g
0
.
45
g
【考点】制备实验方案的设计.
【答案】增大反应物接触面积,加快Mn2+溶出速率;MnO2+4H++2Fe2+═Mn2++2Fe3++2H2O;2Fe3++Fe=3Fe2+,Fe2+循环使用;MnO2;氨水;4.7;5.8;将Al3+、Fe3+沉淀除去;Mn2+-2e-+2H2O=MnO2+4H+;滴定过程中MnO2、KMnO4得电子,Na2C2O4失电子,根据电子守恒有2n(MnO2)+5n(KMnO4)=2n(Na2C2O4),即2n(MnO2)=2×-5×0.1000mol•L-1×0.0200L=0.0100mol,n(MnO2)=0.0050mol,n(MnO2)=nM=0.0050mol×87g/mol=0.4350g,产品的纯度为×100%≈96.67%
1
.
34
g
134
g
/
mol
0
.
4350
g
0
.
45
g
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/25 8:0:9组卷:41引用:1难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
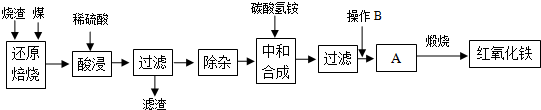
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
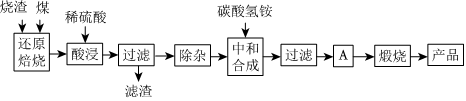
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
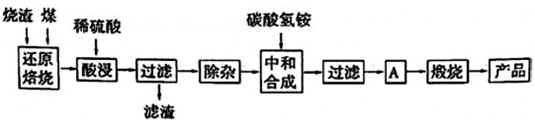
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


