氢能是一种非常清洁的能源,氨分解制备氢气是一种技术先进和经济可行的工艺。恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应2NH3(g)⇌N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如表所示:
| 编号 | 时间/min c(NH3)/(10-3mol•L-1) 表面积/cm2 |
0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
(1)已知H-H、N≡N、N-H的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则2molNH3完全分解吸收的能量为
92
92
kJ。(2)实验①中20~40min,v(NH3)=
2.00×10-5mol⋅L-1⋅min-1
2.00×10-5mol⋅L-1⋅min-1
。(3)实验③达到平衡后,H2的体积分数约为
68.2%
68.2%
(保留三位有效数字)。(4)下列能说明该反应达到平衡状态的是
ce
ce
(填序号)a.2v正(NH3)=3v逆(H2)
b.
c
(
N
2
)
c
(
H
2
)
c.
c
(
N
2
)
c
(
N
H
3
)
d.容器内混合气体密度保持不变
e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是
ac
ac
(填序号)。a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
(6)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
N2+8H++6e-=2
NH
+
4
N2+8H++6e-=2
,A为 NH
+
4
NH4Cl
NH4Cl
(填化学式)。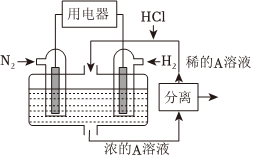
【答案】92;2.00×10-5mol⋅L-1⋅min-1;68.2%;ce;ac;N2+8H++6e-=2;NH4Cl
NH
+
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/11 1:0:9组卷:7引用:1难度:0.5
相似题
-
1.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
2.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。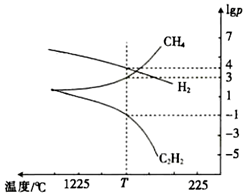
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


