 氯化铵是“侯氏制碱法”的副产品,在工农业生产中具有重要用途。
氯化铵是“侯氏制碱法”的副产品,在工农业生产中具有重要用途。
回答下列问题:
(1)氯化铵的立方晶胞结构如图所示:
①与NH+4等距离且最近的Cl-有 88个。
②若氯化铵的密度为dg/cm3,设NA为阿伏加德罗常数的值,则晶胞参数a=353.5NA•d×107353.5NA•d×107nm(用含d、NA的代数式表示)。
(2)银氨溶液的配制,从电极反应角度探究银镜反应中物质氧化性和还原性的变化进行探究。
资料:
ⅰ.[Ag(NH3)2]+⇌[Ag(NH3)]++NH3 K1=10-3.81
[Ag(NH3)]+⇌Ag++NH3 K2=10-3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式 AgNO3+2NH3•H2O=Ag(NH3)2NO3+2H2OAgNO3+2NH3•H2O=Ag(NH3)2NO3+2H2O。
(3)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e-=Ag
ⅱ.氧化反应:CH3CHO-2e-+3OH-=CH3COO-+2H2OCH3CHO-2e-+3OH-=CH3COO-+2H2O(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH-)增大,乙醛还原性增强。
③补充实验验证②中的分析。

实验操作及现象:
实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转;
实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大;
实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是 可能是硝酸银溶液中的NO-3或O2等微粒作氧化剂,其氧化性随酸性减弱而减弱可能是硝酸银溶液中的NO-3或O2等微粒作氧化剂,其氧化性随酸性减弱而减弱。
(4)设计实验进一步验证。
NH
+
4
3
53
.
5
N
A
•
d
×
1
0
7
3
53
.
5
N
A
•
d
×
1
0
7
N
O
-
3
N
O
-
3
| 实验 | 实验操作 | 实验现象 |
| Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁立即出现银镜 |
合理,⇌Ag++NH3,,c(NH3)增大,平衡逆向移动,c(Ag+)降低,Ag+氧化性减弱,未发生银镜反应;或不合理,灰色浑浊中可能有Ag,Ag+得电子未在试管壁析出,所以无法判断
[
A
g
(
N
H
3
)
]
+
合理,⇌Ag++NH3,,c(NH3)增大,平衡逆向移动,c(Ag+)降低,Ag+氧化性减弱,未发生银镜反应;或不合理,灰色浑浊中可能有Ag,Ag+得电子未在试管壁析出,所以无法判断
。[
A
g
(
N
H
3
)
]
+
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH-)增大,可能是-3价的N也参与了还原+1价的Ag。经检验该假设成立,实验方案及现象是
不加乙醛重复实验Ⅴ中的操作,试管壁出现银镜;或将氨通入含NaOH的潮湿Ag2O固体,水浴加热后出现银镜
不加乙醛重复实验Ⅴ中的操作,试管壁出现银镜;或将氨通入含NaOH的潮湿Ag2O固体,水浴加热后出现银镜
。【答案】8;;AgNO3+2NH3•H2O=Ag(NH3)2NO3+2H2O;CH3CHO-2e-+3OH-=CH3COO-+2H2O;可能是硝酸银溶液中的或O2等微粒作氧化剂,其氧化性随酸性减弱而减弱;合理,⇌Ag++NH3,,c(NH3)增大,平衡逆向移动,c(Ag+)降低,Ag+氧化性减弱,未发生银镜反应;或不合理,灰色浑浊中可能有Ag,Ag+得电子未在试管壁析出,所以无法判断;不加乙醛重复实验Ⅴ中的操作,试管壁出现银镜;或将氨通入含NaOH的潮湿Ag2O固体,水浴加热后出现银镜
3
53
.
5
N
A
•
d
×
1
0
7
N
O
-
3
[
A
g
(
N
H
3
)
]
+
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/12 0:0:0组卷:14引用:1难度:0.5
相似题
-
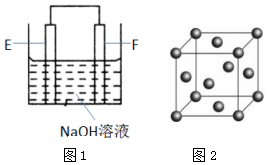 1.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
1.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子.
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为,F的价层电子排布式为.
(2)B、C、D的电负性由大到小的顺序为(用元素符号填写),C与A形成的分子CA3的VSEPR模型为.
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是.
(4)以E、F的单质为电极,组成如图1所示的装置,E极的电极反应式为.
(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体.蓝色沉淀溶解的离子方程式为.
(6)F的晶胞结构(面心立方)如图2所示:已知两个最近的F的距离为acm,F的密度为g/cm3(阿伏加德罗常数用NA表示,F的相对原子质量用M表示)发布:2025/1/18 8:0:1组卷:14引用:2难度:0.5 -
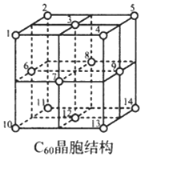 2.碳及其化合物有着重要用途。回答下列问题:
2.碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为。
(2)在CH2=CHCN中,碳原子的杂化方式有、,所含σ键数目和π键数目之比为。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小(由大到小,用H一R-H表示),其原因是。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是。
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20Å (1Å=10-8cm),则C60的晶体密度为g/cm3。
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为Å。发布:2025/1/5 8:0:1组卷:53引用:2难度:0.4 -
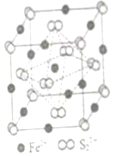 3.铁及其化合物在生产生活及科学研究方面应用非常广泛。
3.铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为;其最外层电子的电子云形状为。
(2)(NH4)2Fe(SO4)2•6H2O俗称摩尔盐
①NH4+电子式为。
②N、O两元素的第一电离能由大到小的顺序为(用元素符号表示)
③SO42-中S原子的杂化方式为,VSEPR模型名称为。
(3)K3[Fe(CN)6]晶体中中心原子的配位数为;晶体的配位体为(用化学符号表示)
(4)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为g•cm-3发布:2025/1/5 8:0:1组卷:7引用:1难度:0.7


