K2FeO4是一种高效多功能的新型消毒剂.
已知:K2FeO4微溶于水,在酸性或中性溶液中快速分解产生O2,在碱性溶液中较稳定.
(1)K2FeO4中铁元素的化合价为 +6+6,具有强氧化性.
(2)一种制备K2FeO4的方法如图.
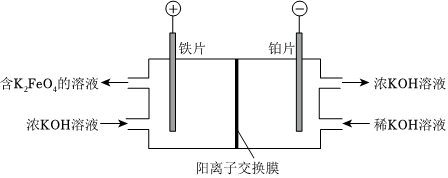
①生成K2FeO4的电极反应式:Fe-6e-+8OH-=FeO2-4+4H2OFe-6e-+8OH-=FeO2-4+4H2O.
②阴极室KOH的浓度提高,结合电极反应式解释原因:阴极发生反应:2H2O+2e-=2OH-+H2↑,OH-浓度增大,K+通过阳离子交换膜进入阴极室阴极发生反应:2H2O+2e-=2OH-+H2↑,OH-浓度增大,K+通过阳离子交换膜进入阴极室.
(3)向含K2FeO4的溶液中加入KOH固体,析出K2FeO4固体,再用稀KOH溶液洗涤,得到K2FeO4产品.用化学方程式解释不能用水洗涤K2FeO4的原因:4K2FeO4+10H2O=4Fe(OH)3+3O2↑+8KOH4K2FeO4+10H2O=4Fe(OH)3+3O2↑+8KOH.
(4)称取ag制得的K2FeO4产品,加入足量NaOH、CrCl3溶液,充分反应后,加入H2SO4调节溶液pH=2,用xmol•L-1FeSO4溶液进行滴定,消耗FeSO4溶液ymL.计算K2FeO4样品的质量分数:0.066xygag×100%0.066xygag×100%.[已知:M(K2FeO4)=198g•mol-1]
涉及的反应有:
FeO2-4+Cr3++3OH-=Fe(OH)3↓+CrO2-4
2CrO2-4+2H+⇌Cr2O2-7+H2O
Cr2O2-7+6Fe2++14H+=2Cr3++6Fe3++7H2O
(5)电解1.5h后,测得η(K2FeO4)=40%,S(K2FeO4)=60%.
已知:η(B)=n(生成B所用的电子)(通过电极的电子)×100%;S(B)=n(生成B所用的铁)n(转化的铁)×100%.
①S(K2FeO4)=60%,说明除K2FeO4之外,还有其他含铁物质生成.经检验,阳极产物中含铁物质仅有K2FeO4和FeOOH,则η(FeOOH)=13.3%13.3%.
②判断阳极有水(或OH-)放电,判断依据:
ⅰ.水(或OH-)有还原性;
ⅱ. η(K2FeO4)+η(FeOOH)=53.3%<100%η(K2FeO4)+η(FeOOH)=53.3%<100%.
F
e
O
2
-
4
F
e
O
2
-
4
0
.
066
xyg
ag
0
.
066
xyg
ag
F
e
O
2
-
4
C
r
O
2
-
4
C
r
O
2
-
4
O
2
-
7
O
2
-
7
n
(
生成
B
所用的电子
)
(
通过电极的电子
)
n
(
生成
B
所用的铁
)
n
(
转化的铁
)
【答案】+6;Fe-6e-+8OH-=+4H2O;阴极发生反应:2H2O+2e-=2OH-+H2↑,OH-浓度增大,K+通过阳离子交换膜进入阴极室;4K2FeO4+10H2O=4Fe(OH)3+3O2↑+8KOH;×100%;13.3%;η(K2FeO4)+η(FeOOH)=53.3%<100%
F
e
O
2
-
4
0
.
066
xyg
ag
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/15 8:0:8组卷:52引用:1难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
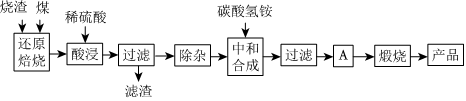
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
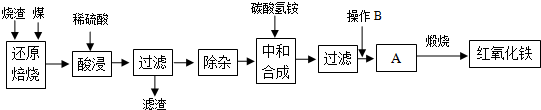
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
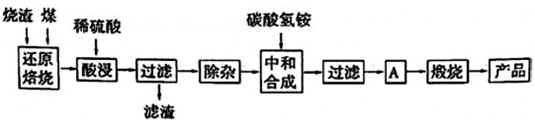
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5
相关试卷


