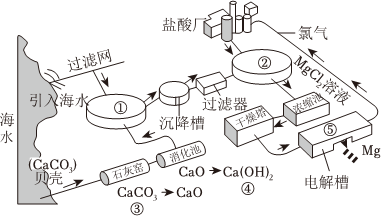
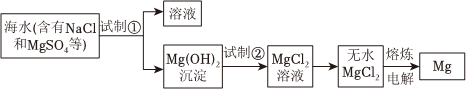
海水是重要的资源,从中可以获得大量NaCl。NaCl的部分用途如图1所示。
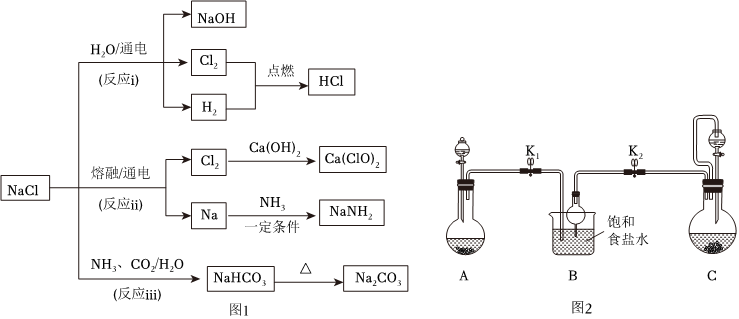
(1)反应ⅰ和ⅱ分别表示氯碱工业和工业制备金属钠的反应原理。
①依据图中转化,写出反应ⅰ的化学方程式:2NaCl+2H2O 通电 2NaOH+H2↑+Cl2↑2NaCl+2H2O 通电 2NaOH+H2↑+Cl2↑。
②比较反应ⅰ和ⅱ,NaCl在水中或熔融状态下均完全电离,而通电时还原产物却不相同。从反应物存在的微粒种类和性质的角度分析,这两个反应中还原产物不同的原因是 NaCl水溶液中存在钠离子和氢离子,通电时氢离子得到电子能力高于钠离子,还原产物为氢气,NaCl在熔融状态下,通电时只有Na+得到电子,还原产物为NaNaCl水溶液中存在钠离子和氢离子,通电时氢离子得到电子能力高于钠离子,还原产物为氢气,NaCl在熔融状态下,通电时只有Na+得到电子,还原产物为Na。
③工业上将Cl2制成漂白粉[有效成分是Ca(ClO)2]的化学方程式为 2Cl2+2Ca(OH)2=CaCl2+Ca(OH)2+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(OH)2+H2O。
④NaNH2(氨基钠)可用于有机合成。它有很强的吸水性,其固体在空气中吸水后产生刺激性气味气体,实验室中检验该气体的方法是 取湿润的红色石蕊试纸,靠近气体,试纸变蓝色,证明气体为氨气取湿润的红色石蕊试纸,靠近气体,试纸变蓝色,证明气体为氨气。
(2)反应ⅲ用于工业制纯碱。实验室中模拟该反应的装置如2图所示。
①装置A、B、C中,用于制备NH3的是 CC,判断的依据是 氨气极易溶于水,通入水溶液中需要防止倒吸氨气极易溶于水,通入水溶液中需要防止倒吸。
②为了提高原料的利用率,从而得到更多的产物,模拟实验过程中应先打开的弹簧夹是 K2K2(填“K1”或“K2”)。
通电
通电
【考点】海水资源及其综合利用.
【答案】2NaCl+2H2O 2NaOH+H2↑+Cl2↑;NaCl水溶液中存在钠离子和氢离子,通电时氢离子得到电子能力高于钠离子,还原产物为氢气,NaCl在熔融状态下,通电时只有Na+得到电子,还原产物为Na;2Cl2+2Ca(OH)2=CaCl2+Ca(OH)2+H2O;取湿润的红色石蕊试纸,靠近气体,试纸变蓝色,证明气体为氨气;C;氨气极易溶于水,通入水溶液中需要防止倒吸;K2
通电
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/13 8:0:9组卷:62引用:1难度:0.7