实验小组探究Fe(OH)3胶体的制备方法及其性质。
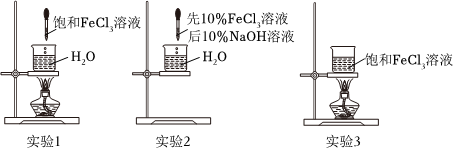
(1)制备Fe(OH)3胶体
| 实验 | 实验操作 | 丁达尔效应 |
| 1 | 向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(浓度约为30%) | 迅速出现 |
| 2 | 向40mL蒸馏水中滴入5滴10%FeCl3溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 | 迅速出现 |
| 3 | 加热40mL饱和FeCl3溶液 | 一段时间后出现 |
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
。 △
②实验2与实验1对比,优点是
不需加热,FeCl3溶液浓度小
不需加热,FeCl3溶液浓度小
(写出1条即可)。③综合上述实验:制备Fe(OH)3胶体提供OH-的物质可以是
NaOH
NaOH
或强碱,控制反应条件即可制得。(2)Fe(OH)3胶体的性质
资料:
Ⅰ.pH>10时,Fe(OH)3胶体溶解。
Ⅱ.固体FeCl3易升华(物质从固态不经过液态直接变成气态的过程)。
Ⅲ.Fe3+检验:若待测液中加入KSCN溶液,溶液变红色,则说明待测液中含有Fe3+。
实验4:取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体。
①根据资料,推测漏斗内棕褐色的烟中主要含有
FeCl3
FeCl3
(填化学式)。②设计检验蒸发皿中红棕色固体中阳离子的方案:
取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+
取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+
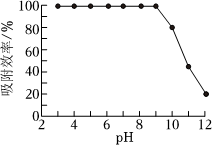
。(3)研究表明:Fe(OH)3胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。不同pH时,测得溶液中Fe(OH)3胶体对砷酸的吸附效率如图。pH为
3~9
3~9
时,Fe(OH)3胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是 pH>10时,Fe(OH)3胶体溶解
pH>10时,Fe(OH)3胶体溶解
。
(4)去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀,化学方程式是
Fe(OH)3(胶体)+H3AsO4=FeAsO4↓+3H2O
Fe(OH)3(胶体)+H3AsO4=FeAsO4↓+3H2O
。【答案】FeCl3+3H2O Fe(OH)3(胶体)+3HCl;不需加热,FeCl3溶液浓度小;NaOH;FeCl3;取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+;3~9;pH>10时,Fe(OH)3胶体溶解;Fe(OH)3(胶体)+H3AsO4=FeAsO4↓+3H2O
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/22 0:0:1组卷:4引用:2难度:0.6
相似题
-
 1.如图所示为实验室中制备胶体的一种方法。下列说法正确的是( )发布:2024/12/11 4:0:1组卷:90引用:5难度:0.8
1.如图所示为实验室中制备胶体的一种方法。下列说法正确的是( )发布:2024/12/11 4:0:1组卷:90引用:5难度:0.8 -
2.日常生活中我们会接触到不同的分散系。
(1)溶液、胶体和浊液这三种分散系的根本区别是。
A.是否有丁达尔现象
B.能否透过滤纸
C.分散质粒子直径的大小
D.是否均一、稳定、透明
(2)下列实验装置或操作与粒子的大小无直接关系的是。
(3)将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验,下列说法正确的是。
A.烧杯内液体加入碘水后呈蓝色
B.烧杯内液体加入硝酸银溶液后有白色沉淀产生
C.袋内液体加入硝酸银溶液后无变化
D.袋内液体加入碘水后不变蓝
(4)制备Fe(OH)3胶体时,将逐滴滴加至中,待液体呈红褐色后,停止加热;反应方程式为。发布:2024/10/6 10:0:2组卷:16引用:1难度:0.5 -
3.关于氢氧化铁胶体,下列说法正确的是( )
发布:2024/10/6 4:0:1组卷:17引用:1难度:0.5


