硫酸铜及硫酸铜晶体(CuSO4•5H2O,相对分子质量为250)广泛应用于生产、生活及实验中。
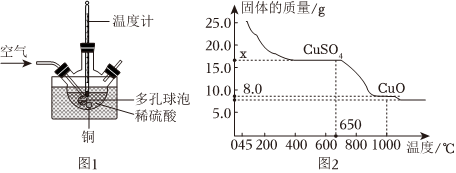
Ⅰ、硫酸铜制取
方案一:Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O。
方案二:将废铜屑倒入稀硫酸中,控温80℃并通入氧气制备硫酸铜。
(1)图1是方案二实验室模拟工业制备硫酸铜的装置。反应的化学方程式为 2Cu+O2+2H2SO480℃ 2CuSO4+2H2O2Cu+O2+2H2SO480℃ 2CuSO4+2H2O。
(2)从绿色化学的观点出发,上述两个方案中,你认为比较合理的是 方案二方案二(填“方案一”或“方案二”)。
Ⅱ、硫酸铜晶体的性质
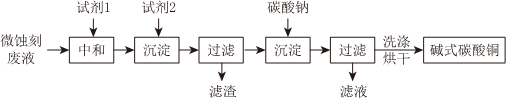
(3)将25.0g胆矾放在坩埚内加热,固体质量与成分随温度变化的曲线如图2,加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,求CuO完全分解时产生该气体的质量(写出计算过程)。
Ⅲ、硫酸铜应用
(4)切割钢板时,通常利用硫酸铜溶液在钢板上先画出红线,该反应的化学方程式为 Fe+CuSO4=FeSO4+CuFe+CuSO4=FeSO4+Cu。
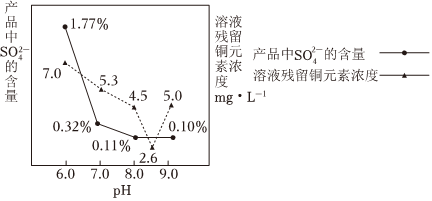
(5)工业上用含有硫酸铜的微蚀刻废液(含有一定量Cu2+、H+、SO2-4、H2O2和微量Fe3+)来制备高纯度碱式碳酸铜[Cu2(OH)2CO3],用于生产木材防腐剂等。其制备过程如下:
①第二次“沉淀”时的反应为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2 Na2SO4Na2SO4+CO2↑。
②烘干时若产品中出现少量黑色物质,可能的原因为 烘干温度高,部分碱式碳酸铜受热分解生成氧化铜烘干温度高,部分碱式碳酸铜受热分解生成氧化铜。
③第二次“沉淀”时,若有少量5Cu(OH)2•2CuCO3生成,则产品中铜元素的质量分数 偏大偏大。(填“偏大”“不变”或“偏小”)
④加入Na2CO3进行反应时,反应液pH对产品中的SO2-4含量以及反应液中Cu2+沉淀效率的影响如图所示,此时溶液pH最好控制在 8.5左右8.5左右。
△
80
℃
80
℃
SO
2
-
4
SO
2
-
4
【答案】2Cu+O2+2H2SO4 2CuSO4+2H2O;方案二;Fe+CuSO4=FeSO4+Cu;Na2SO4;烘干温度高,部分碱式碳酸铜受热分解生成氧化铜;偏大;8.5左右
80
℃
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/29 8:0:9组卷:144引用:5难度:0.5
相似题
-
1.新冠肺炎疫情防控期间,西安市各学校开展全域喷洒低浓度、有效成分是次氯酸钠的“84”消毒液进行消毒。如图所示是模拟制备“84”消毒液的流程(Cl2是一种黄绿色的有毒气体)。请回答下列问题:
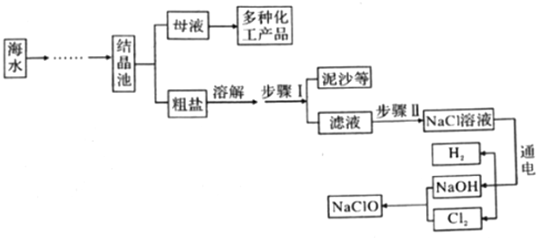
(1)NaOH的俗称为(写一种)。
(2)步骤Ⅱ中,通常用碳酸钠溶液除去滤液中的氯化钙杂质,请写出有关反应的化学方程式。
(3)电解水时,一般在水中加入少量NaOH以增强水的导电性,不能加入NaCl的原因是。发布:2025/1/3 8:0:1组卷:6引用:1难度:0.5 -
2.某种家用的消毒液的主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,下列说法错误的是( )
发布:2025/1/3 8:0:1组卷:71引用:1难度:0.7 -
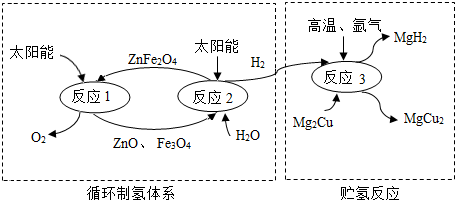 3.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5
3.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5


