碘酸钾(KIO3)为白色固体,可溶于水,常作为补碘剂被添加到食盐中。小组同学实验探究其性质如下:
【实验1】探究KIO3的热稳定性。按如图装置完成实验:
| 序号 | 1-1 | 1-2 |
| 装置 |  |
 |
| 现象 | 加热较长时间后,导管口持续产生气泡 | a |
(1)食盐中加碘可预防
甲状腺
甲状腺
疾病。(2)实验1-1结束时,应进行的操作是先
从水中取出导管
从水中取出导管
,后 熄灭酒精灯
熄灭酒精灯
。(3)实验1-2中a处现象为
带火星的木条复燃
带火星的木条复燃
,说明1-1中收集到的气体是氧气。由此证明碘酸钾与氯酸钾一样受热会分解且反应相似,请写出碘酸钾受热分解的文字表达式 碘酸钾碘化钾+氧气
加热
碘酸钾碘化钾+氧气
。加热
【实验2】探究KIO3与维生素C的反应及其影响因素。分别取不同浓度的碘酸钾和维生素C溶液按下表进行实验:
【查阅资料】
Ⅰ.淀粉溶液遇单质碘(I2)变为蓝色,遇KIO3、维生素C、醋酸均不变色。
Ⅱ.单质碘受热易升华;西兰花、卷心菜、番茄等蔬菜中含有较丰富的维生素C;食醋中含有约3%的醋酸。
| 装置 | 序号 | 溶液的浓度 | 实验现象 | |
| 碘酸钾 | 维生素 | |||
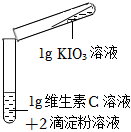 |
2-1 | 10% | 10% | 溶液立即由无色变为蓝色 |
| 2-2 | 0.5% | 0.5% | 溶液慢慢由无色变为蓝色 | |
| 2-3 | 0.25% | 0.25% | 一段时间后溶液无明显变化,再滴入5滴稀醋酸后,溶液逐渐变为浅蓝色 | |
(4)根据实验中“KIO3溶液与维生素C溶液均不能使淀粉变蓝色,但是两者混合后淀粉变蓝色”这一实验现象可得出的结论是
KIO3能与维生素C反应生成I2
KIO3能与维生素C反应生成I2
。(5)对比实验2-1、2-2,可探究的影响KIO3与维生素C反应的因素是
反应物的浓度
反应物的浓度
。(6)甲同学由实验2-3得出结论:醋酸会促进KIO3与维生素C的反应。乙同学认为该结论不严谨,其理由是
有可能是醋酸和碘酸钾反应生成了I2
有可能是醋酸和碘酸钾反应生成了I2
;为此可补充实验 取1g0.25%的碘酸钾溶液,加入2滴淀粉溶液,再加入5滴稀醋酸,溶液没有变蓝,说明醋酸不能和碘酸钾反应生成I2
取1g0.25%的碘酸钾溶液,加入2滴淀粉溶液,再加入5滴稀醋酸,溶液没有变蓝,说明醋酸不能和碘酸钾反应生成I2
(写出实验操作、现象和结论)。(7)由以上实验可知:在使用添加了碘酸钾的食盐时,为减少碘的损失,除了要在菜起锅时才加食盐外还要
在烹调西兰花、卷心菜、番茄等含有较丰富维生素C的蔬菜时不要加食醋
在烹调西兰花、卷心菜、番茄等含有较丰富维生素C的蔬菜时不要加食醋
。【考点】实验探究物质的性质或变化规律.
【答案】甲状腺;从水中取出导管;熄灭酒精灯;带火星的木条复燃;碘酸钾碘化钾+氧气;KIO3能与维生素C反应生成I2;反应物的浓度;有可能是醋酸和碘酸钾反应生成了I2;取1g0.25%的碘酸钾溶液,加入2滴淀粉溶液,再加入5滴稀醋酸,溶液没有变蓝,说明醋酸不能和碘酸钾反应生成I2;在烹调西兰花、卷心菜、番茄等含有较丰富维生素C的蔬菜时不要加食醋
加热
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/14 0:0:1组卷:32引用:2难度:0.4
相似题
-
1.碳酸氢钠是一种应用广泛的盐,化学小组对其进行了探究。
(1)NaHCO3可称为钠盐或碳酸氢盐,它是由Na+和(填离子符号)构成,医疗上能用于治疗胃酸(含有盐酸)过多症,反应的化学方程式为。
【提出问题】实验室中如何制取少量NaHCO3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3Na2CO3+CO2↑+H2O。△
材料二:研究发现,NaHCO3溶于水时吸收热量,Na2CO3溶于水时放出热量。
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO3。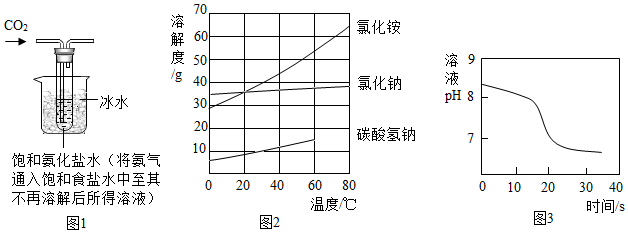
反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是。
(3)能进一步确认该白色固体是NaHCO3的实验方案是(须用到的仪器和药品:试管、温度计、水)。
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是。
【性质探究】
常温下,取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。
【查阅资料】
材料三NaHCO3溶于水后,少量的能同时发生如下变化:HCO-3
变化①:+H2O→H2CO3+OH-;HCO-3
变化②:→HCO-3+H+。CO2-3
材料四:溶液的酸碱性与溶液中H+和OH-数目的相对大小有关。常温下,当单位体积溶液中OH-的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液显(填“酸”“碱”或“中”)性,结合材料三、四从微观角度说明原因:。
(6)根据本实验,下列说法错误的是(填字母)。
a.pH<6.68时生成的无色气体为CO2
b.从0~30s,单位体积溶液中H+数目不断增大
c.不能用CaCl2溶液鉴别Na2CO3和NaHCO3溶液发布:2024/12/25 15:30:1组卷:591引用:4难度:0.5 -
2.关于盐的性质研究是一项重要的课题,某兴趣小组以“探究碳酸氢钠的性质”为主题开展项目式学习。
【任务一】认识碳酸氢钠
(1)下列关于碳酸氢钠的说法正确的是。
A.碳酸氢钠是由Na+和构成HCO-3
B.碳酸氢钠俗称纯碱
C.碳酸氢钠医疗上能用于治疗胃酸过多症
D.碳酸氢钠难溶于水
【任务二】探究碳酸氢钠的性质
(2)探究碳酸氢钠与稀盐酸反应:兴趣小组取适量碳酸氢钠粉末于甲试管中,加入稀盐酸,如图1所示,观察到甲试管中有气泡产生,乙中,说明碳酸氢钠能与稀盐酸反应生成CO2,写出试管甲中反应的化学方程式。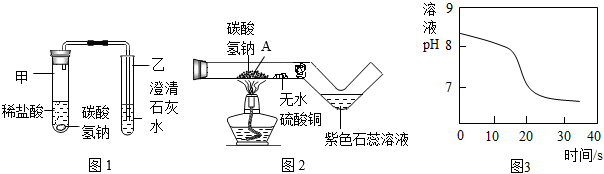
(3)探究碳酸氢钠的热稳定性:用酒精灯充分加热玻璃管,如图2所示。
资料:无水硫酸铜呈白色,遇水后呈蓝色
①发现玻璃管内无水硫酸铜变蓝,紫色石蕊溶液变红,说明碳酸氢钠受热易分解,且有和二氧化碳生成。
②实验后兴趣小组同学猜想玻璃管A处固体产物仅是Na2CO3而不含有NaOH,请设计实验证明(写出具体步骤和现象):。
(4)常温下,兴趣小组同学取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。
【查阅资料】
材料一:NaHCO3溶于水后,少量的能同时发生如下变化:HCO-3
变化①:+H2O→H2CO3+OH-HCO-3
变化②:→HCO-3+H+CO2-3
材料二:溶液的酸碱性与溶液中H+和OH-数目的相对大小有关。常温下,当单位体积溶液中OH-的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
①根据上述实验可知NaHCO3溶液显碱性,结合材料一、二从微观角度说明原因:。
②根据本实验,可知从0~30s,单位体积溶液中H+数目不断(填“增大”或“减小”)。发布:2024/12/25 17:0:2组卷:94引用:2难度:0.4 -
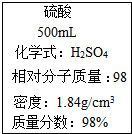 3.图是一瓶浓硫酸标签上的部分内容,某探究小组的同学对这瓶硫酸进行了如下探究,请你参与.
3.图是一瓶浓硫酸标签上的部分内容,某探究小组的同学对这瓶硫酸进行了如下探究,请你参与.
[查阅资料]浓硫酸有强腐蚀性,溶于水会放热;硫酸钡不溶于水也不溶于酸.
[探究一]浓硫酸稀释时会放热.
(1)稀释浓硫酸时,所需仪器主要有,应如何稀释浓硫酸?.测量稀释前后溶液的温度,有明显升高的现象.结论:浓硫酸溶于水放热.
[探究二]稀硫酸与氢氧化钠溶液能发生反应.图10
(2)稀硫酸与氢氧化钠溶液反应的化学方程式为实验步骤 实验现象 实验结论 先用pH试纸测定稀硫酸的pH,再逐滴加入氢氧化钠溶液并不断振荡,同时测混合液的pH pH逐渐变大,
最后pH≥7稀硫酸与氢氧化钠
溶液能发生反应.
(3)实验中仅从溶液pH变大,而不强调pH≥7,不能得出稀硫酸与氢氧化钠溶液一定发生反应的结论,理由是.
[探究三]由于该试剂瓶瓶口密封签已破损,同学们怀疑该浓硫酸的质量分数与标签不相符.
[提出问题]该浓硫酸的质量分数是否发生变化?
[实验探究](4)取该浓硫酸和足量BaCl2溶液反应,过滤、洗涤、干燥沉淀.实验中如何确定硫酸已完全反应.
(5)为达到实验目的,实验中必须要测知的数据是.
[探究结论](6)由实验测得的数据计算出的硫酸的质量分数与标签不符.该硫酸的质量分数应98%(填“大于”或“小于”).发布:2025/1/6 8:0:1组卷:38引用:1难度:0.5


