现用盐酸标准溶液来测定NaOH溶液的浓度。有以下实验操作:
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点
④重复以上操作
⑤配制250mL盐酸标准溶液
⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是 ⑤②①③④⑥⑤②①③④⑥(填序号),上述操作②中使用的仪器除锥形瓶外,还需要 用酸式滴定管量取20.00mL盐酸溶液用酸式滴定管量取20.00mL盐酸溶液,用 酚酞酚酞作指示剂。
(2)滴定中眼睛应注视 锥形瓶中溶液颜色变化锥形瓶中溶液颜色变化,出现 溶液由无色变为浅红色,且30s内不褪色即达到滴定终点溶液由无色变为浅红色,且30s内不褪色即达到滴定终点即达到滴定终点。
(3)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(HCl)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
19
.
98
+
20
.
00
+
20
.
80
+
20
.
02
4
不合理
不合理
(填“合理”或“不合理”),理由是 第三组数据误差较大
第三组数据误差较大
。通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a <
<
(填“>”“<”或“=”)20.02。
(4)滴定过程中,若装标准溶液的滴定管末端的气泡未赶走,则测定结果
偏大
偏大
,若锥形瓶未用待测液润洗,测定结果 无影响
无影响
,锥形瓶摇动过程有液体飞溅出来,测定结果 偏小
偏小
(填“偏高”、“偏低”或“无影响”)。【考点】中和滴定.
【答案】⑤②①③④⑥;用酸式滴定管量取20.00mL盐酸溶液;酚酞;锥形瓶中溶液颜色变化;溶液由无色变为浅红色,且30s内不褪色即达到滴定终点;不合理;第三组数据误差较大;<;偏大;无影响;偏小
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/12 5:0:1组卷:18引用:1难度:0.6
相似题
-
1.下列实验方法或操作正确的是( )
发布:2024/12/12 8:0:1组卷:9引用:1难度:0.7 -
2.食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL,实验室用标准NaOH溶液测定食醋中醋酸的浓度,以检测食醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示,请回答:
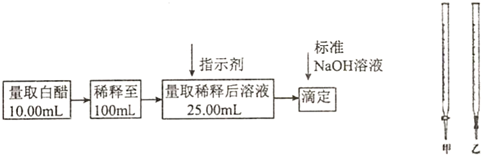
(1)选用上述(填“甲”或“乙”)滴定管量取10.00mL白醋后,将白醋稀释至100mL时,需要使用的玻璃仪器有烧杯、玻璃棒和.
(2)某同学用酸碱中和滴定法测定该品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中=c(CH3COOH)c(CH3COO-),则此时溶液中的pH=11.8×103.(已知:室温下醋酸的Ka=1.8×10-5)
(3)根据该同学的计算结果,应该选作指示剂.(填“酚酞”、“甲基橙”或“石蕊”)
(4)该滴定达到终点时的现象是.
(5)某次实验滴定开始和结束时,碱式滴定管中的液面如下图所示,则所用NaOH溶液的体积为mL.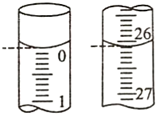
(6)用标准的0.06000mol⋅L-1NaOH溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:
则该品牌白醋中醋酸含量为滴定次数 待测溶液的体积/mL 标准溶液的体积 滴定前刻度/mL 滴定后刻度/mL 1 25.00mL 0.02 25.01 2 25.00mL 0.70 25.71 3 25.00mL 0.50 24.2 mg/mL.
(7)下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是.(填编号)
A.取待测液的滴管,取液前滴定管尖嘴处无气泡,取液后尖嘴处出现气泡
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
D.读取NaOH溶液体积时,开始时俯视读数,滴定结束时仰视读数
(8)有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,现把管内液体全部放出,用量筒接收,得到溶液的体积是.
A.等于10mL
B.等于40mL
C.大于40mL
D.不能确定发布:2024/12/30 3:0:4组卷:54引用:2难度:0.6 -
3.下面关于中和滴定的实验操作叙述不正确的有( )
①将锥形瓶用蒸馏水和待测定的盐酸溶液进行洗涤
②取20mL待测定的盐酸溶液,注入锥形瓶中
③向锥形瓶中加入几滴酚酞试液为指示剂
④碱式滴定管用蒸馏水洗涤后,直接注入已知浓度的NaOH溶液
⑤进行中和滴定时,一旦锥形瓶内溶液由无色变成粉红色,即可停止滴定
⑥记录数据,进行必要的数据处理和得出结论发布:2024/12/10 0:30:1组卷:94引用:2难度:0.7


