元素钴位于周期表中的第四周期第Ⅷ族,常见的化合价有+2和+3价。科研人员设计在催化剂的作用下,利用浓氨水、氯化铵、双氧水和CoCl2制备CoCl3⋅6NH3。实验装置如图1:
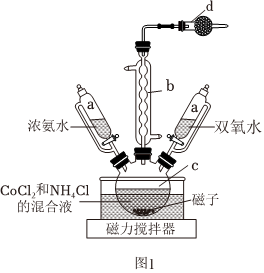
实验步骤:
①首先将活性炭、CoCl2和氯化铵在仪器C中混合,再滴加浓氨水使溶液颜色变为黑紫色。
②置于冰水浴中冷却至10℃以下,缓慢滴加双氧水并不断捞拌。
③转移至60℃热水浴中,恒温加热30min,同时缓慢搅拌。
④将反应后的混合物冷却到0℃左右,抽滤得到CoCl3⋅6NH3粗产品。
⑤粗产品需要经过沸盐酸溶解、趁热过滤、再往滤液中慢慢加入10mL浓HCl,即有大量的橘黄色晶体析出,用冰水浴冷却后抽滤。
⑥所得晶体用冷的浓盐酸洗涤、再加少许____洗涤、烘干等操作得到较纯CoCl3⋅6NH3。
已知:a.Co(OH)2开始沉淀pH=9。
b.CoCl3⋅6NH3为橘黄色晶体,难溶于乙醇。
请回答下列问题:
(1)仪器b的名称为 球形冷凝管球形冷凝管。
(2)仪器d中所盛药品为 无水CaCl2无水CaCl2,其作用主要为吸收挥发出来的氨气。
(3)60℃恒温加热的优点是 防止温度过高导致氨气挥发以及双氧水分解防止温度过高导致氨气挥发以及双氧水分解。
(4)步骤⑥中,再加少许 乙醇乙醇洗涤。
(5)反应器中发生的总反应化学方程式为 2CoCl2+10NH3•H2O+H2O2+2NH4Cl=2CoCl3⋅6NH3↓+12H2O2CoCl2+10NH3•H2O+H2O2+2NH4Cl=2CoCl3⋅6NH3↓+12H2O。
(6)取5.0mL0.01mol/LCoCl3⋅6NH3溶液和5.0mL0.01mol/LCoCl3⋅5NH3溶液,分别用浓度为0.01mol/LAgNO3溶液进行滴定,滴数传感器记录滴加AgNO3溶液的体积,电极电位传感器测溶液电极电位的变化所得图象如图2,3:
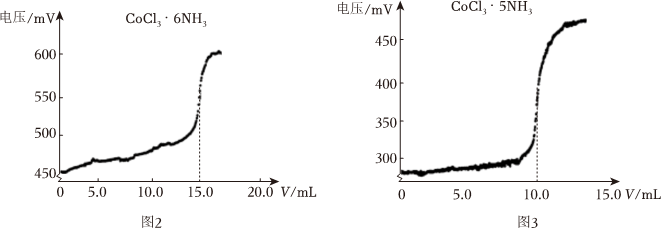
已知该配合物中Co3+的配位数为6,则CoCl3⋅6NH3用内界外界表示为 [Co(NH3)6]Cl3[Co(NH3)6]Cl3,1molCoCl3⋅5NH3配合物中含有σ键的数目为 21×6.02×1023(或21NA)21×6.02×1023(或21NA)。
【考点】制备实验方案的设计.
【答案】球形冷凝管;无水CaCl2;防止温度过高导致氨气挥发以及双氧水分解;乙醇;2CoCl2+10NH3•H2O+H2O2+2NH4Cl=2CoCl3⋅6NH3↓+12H2O;[Co(NH3)6]Cl3;21×6.02×1023(或21NA)
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/2 8:0:9组卷:3引用:1难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
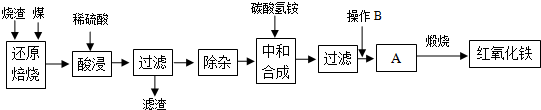
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
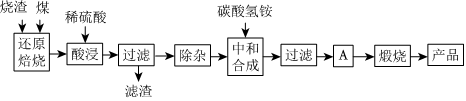
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
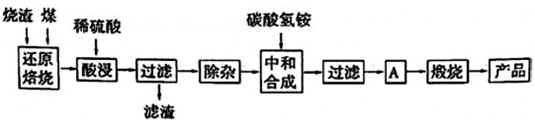
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


