卤素(F、Cl、Bi、I)可形成许多结构和性质特殊的化合物。回答下列问题。
(1)F原子的核外电子有 55种空间运动状态,F的第一电离能 <<(填“<”或“>”)Ne的第一电离能。
(2)-40℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 分子晶体分子晶体,HOF水解的产物为 HF、H2O2HF、H2O2(填化学式)。
(3)Cl2O的中心原子为O,O原子的轨道杂化方式为 sp3sp3;ClO2的中心原子为Cl,其分子空间构型与Cl2O相同,但ClO2中存在大π键(π35),则ClO2中O-Cl-O键角 >>(填“>”“<”或“=”)Cl2O中Cl-O-Cl键角。
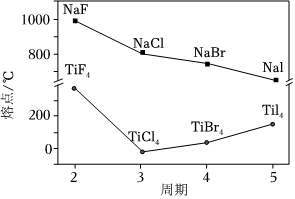
(4)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,TiX4的熔点呈如图变化趋势的原因为 TiCl4、TiBr4、TiI4为结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大,熔点依次逐渐升高,TiF4为离子晶体,熔点最高TiCl4、TiBr4、TiI4为结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大,熔点依次逐渐升高,TiF4为离子晶体,熔点最高。
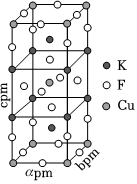
(5)一定条件下,K、CuCl2和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu的化合价为+2,X的化学式为 K2CuF4K2CuF4,若阿伏加德罗常数的值为NA,则化合物X的密度为 4.36×1032NAa2c4.36×1032NAa2cg/cm3(用含NA、a、c的代数式表示)。
4
.
36
×
1
0
32
N
A
a
2
c
4
.
36
×
1
0
32
N
A
a
2
c
【答案】5;<;分子晶体;HF、H2O2;sp3;>;TiCl4、TiBr4、TiI4为结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大,熔点依次逐渐升高,TiF4为离子晶体,熔点最高;K2CuF4;
4
.
36
×
1
0
32
N
A
a
2
c
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/24 9:0:2组卷:19引用:1难度:0.5
相似题
-
 1.碳及其化合物有着重要用途。回答下列问题:
1.碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为。
(2)在CH2=CHCN中,碳原子的杂化方式有、,所含σ键数目和π键数目之比为。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小(由大到小,用H一R-H表示),其原因是。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是。
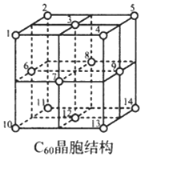
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20Å (1Å=10-8cm),则C60的晶体密度为g/cm3。
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为Å。发布:2025/1/5 8:0:1组卷:53引用:2难度:0.4 -
 2.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
2.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子.
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为,F的价层电子排布式为.
(2)B、C、D的电负性由大到小的顺序为(用元素符号填写),C与A形成的分子CA3的VSEPR模型为.
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是.
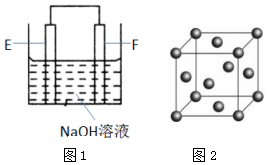
(4)以E、F的单质为电极,组成如图1所示的装置,E极的电极反应式为.
(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体.蓝色沉淀溶解的离子方程式为.
(6)F的晶胞结构(面心立方)如图2所示:已知两个最近的F的距离为acm,F的密度为g/cm3(阿伏加德罗常数用NA表示,F的相对原子质量用M表示)发布:2025/1/18 8:0:1组卷:14引用:2难度:0.5 -
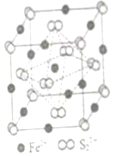 3.铁及其化合物在生产生活及科学研究方面应用非常广泛。
3.铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为;其最外层电子的电子云形状为。
(2)(NH4)2Fe(SO4)2•6H2O俗称摩尔盐
①NH4+电子式为。
②N、O两元素的第一电离能由大到小的顺序为(用元素符号表示)
③SO42-中S原子的杂化方式为,VSEPR模型名称为。
(3)K3[Fe(CN)6]晶体中中心原子的配位数为;晶体的配位体为(用化学符号表示)
(4)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为g•cm-3发布:2025/1/5 8:0:1组卷:7引用:1难度:0.7


